Pytanie 1
Błąd związany z odczytem poziomu cieczy w kolbie miarowej, spowodowany niewłaściwą pozycją oka w stosunku do skali, nazywany jest błędem
Wynik: 23/40 punktów (57,5%)
Wymagane minimum: 20 punktów (50%)
Błąd związany z odczytem poziomu cieczy w kolbie miarowej, spowodowany niewłaściwą pozycją oka w stosunku do skali, nazywany jest błędem
Proces oddzielania cieczy od osadu nazywa się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie urządzenie służy do pomiaru temperatury topnienia substancji chemicznych?
Woda używana w laboratorium chemicznym, uzyskana poprzez filtrację przez wymieniacz jonowy, jest określana mianem wody
Jakie jest stężenie roztworu HNO3, który powstał w wyniku połączenia 50 cm3 roztworu HNO3 o stężeniu 0,2 mol/dm3 oraz 25 cm3 roztworu HNO3 o stężeniu 0,5 mol/dm3?
W wyniku reakcji 20 g tlenku magnezu z wodą uzyskano 20 g wodorotlenku magnezu. Oblicz efektywność reakcji.
MMg = 24 g/mol, MO = 16 g/mol, MH = 1 g/mol?
Aby oddzielić galaretowaty osad typu Fe(OH)3 od roztworu, jaki sączek należy zastosować?
Na ilustracji oznaczono numery 1 i 4:
Próbkę laboratoryjną dzieli się na dwie części, ponieważ
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jak definiuje się próbkę wzorcową?
Podaj nazwę reagentu chemicznego, który w specyficznych warunkach reaguje tylko z jednym jonem, pierwiastkiem lub związkiem chemicznym?
Aby przygotować 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3, jaką kolbę miarową o pojemności należy wykorzystać?
W tabeli zestawiono objętości molowe czterech gazów odmierzone w warunkach normalnych.
Dla którego spośród wymienionych w tabeli gazów objętość molowa najbardziej odchyla się od wartości obliczonej dla gazu doskonałego?
| Gaz | SO2 | CHCl3(para) | O3 | NH3 |
|---|---|---|---|---|
| Objętość molowa (dm3/mol) | 21,89 | 22,60 | 21,6 | 22,08 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie środki ochronne należy zastosować podczas sporządzania 1M roztworu zasady sodowej ze stężonego roztworu NaOH, na opakowaniu którego widnieje oznaczenie S/36/37/39?
| Numer zwrotu S | Warunki bezpiecznego stosowania |
|---|---|
| S36 | Używać odpowiedniej odzieży ochronnej |
| S37 | Używać odpowiednich rękawic |
| S38 | W przypadku niewystarczającej wentylacji używać sprzętu do oddychania |
| S39 | Używać okularów lub maski ochronnej |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakim rozpuszczalnikiem o niskiej temperaturze wrzenia wykorzystuje się do suszenia szkła laboratoryjnego?
Z podanych w tabeli danych wybierz sprzęt potrzebny do zmontowania zestawu do destylacji z parą wodną.
| 1 | 2 | 3 | 4 | 5 |
| manometr | kociołek miedziany | chłodnica powietrzna | kolba destylacyjna | odbieralnik |
Proces chemiczny, który polega na przejściu substancji w stanie stałym do roztworu, związany z reakcją tej substancji z rozpuszczalnikiem, to
Między wodorotlenkiem baru a chlorkiem amonu dochodzi do spontanicznej reakcji, która powoduje silne schłodzenie mieszaniny oraz wydobycie się charakterystycznego zapachu amoniaku.
Ba(OH)2(s) + 2 NH4Cl(s) → BaCl2(aq) + 2 H2O(c) + 2 NH3(g) Wskaź, które sformułowanie właściwie wyjaśnia to zjawisko.
nieodwracalnie jej równowagę.
Odczynnik chemiczny, w którym zawartość domieszek wynosi od 1 do 10%, jest nazywany odczynnikiem
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Skrót "cz." na etykiecie odczynnika chemicznego wskazuje, że
Nie należy używać do czyszczenia szklanych naczyń laboratoryjnych
Ustalanie miana roztworu polega na
Sód metaliczny powinien być przechowywany w laboratorium
Z uwagi na bezpieczeństwo pracy, ciecze żrące powinny być podgrzewane w łaźniach
Próbki wody, które mają być badane pod kątem zawartości krzemu, powinny być przechowywane w pojemnikach
Jakie jest stężenie roztworu NaOH, który zawiera 4 g wodorotlenku sodu w 1 dm3 (masa molowa NaOH = 40 g/mol)?
Próbka pobrana z próbki ogólnej, która odzwierciedla cechy partii produktu, określa się jako próbka
Przedstawiony schemat ideowy ilustruje proces wytwarzania N2 → NO → NO2 → HNO3
Przedstawiony schemat ideowy ilustruje proces syntezy z propanu C3H8 → C3H7Cl → C3H6 → C3H6(OH)2 → C3H5(OH)2Cl → C3H5(OH)3
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby obliczyć gęstość cieczy przy użyciu metody hydrostatycznej, należy zastosować
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
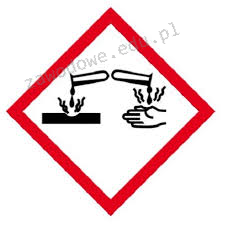
Podczas przygotowywania roztworu mianowanego kwasu solnego o określonym stężeniu należy:
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.