Pytanie 1
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wynik: 30/40 punktów (75,0%)
Wymagane minimum: 20 punktów (50%)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby przeprowadzić syntezę substancji organicznej w temperaturze 150°C, należy zastosować łaźnię
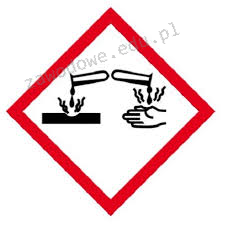
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Z partii materiału należy pobrać ogólną próbkę w ilości odpowiadającej promilowi całej partii. Na podstawie podanej informacji określ, ile pierwotnych próbek, każda ważąca 10 g, trzeba pobrać z partii cukru o masie 0,5 t, aby uzyskać reprezentatywną próbkę ogólną?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jeżeli partia towaru składa się z 10 dużych opakowań, wtedy z jednego opakowania pobiera się kilka próbek, które następnie łączy, uzyskując próbkę
Jak nazywa się naczynie o płaskim dnie, które wykorzystuje się do pozyskiwania substancji stałej poprzez stopniowe odparowanie rozpuszczalnika z roztworu?
Urządzeniem pomiarowym nie jest
Na podstawie danych zawartych w tabeli wskaż, który dodatek należy zastosować, w celu konserwacji próbek wody przeznaczonych do oznaczania jej twardości.
| Tabela. Techniki konserwacji próbek wody | |
|---|---|
| Stosowany dodatek lub technika | Rodzaje próbek, do których dodatek lub technika jest stosowana |
| Kwas siarkowy(VI) | zawierające węgiel organiczny, oleje lub tłuszcze, przeznaczone do oznaczania ChZT, zawierające aminy lub amoniak |
| Kwas azotowy(V) | zawierające związki metali |
| Wodorotlenek sodu | zawierające lotne kwasy organiczne lub cyjanki |
| Chlorek rtęci(II) | zawierające biodegradowalne związki organiczne oraz różne formy azotu i fosforu |
| Chłodzenie w temperaturze 4°C | zawierające mikroorganizmy, barwę, zapach, organiczne formy węgla, azotu i fosforu, przeznaczone do określenia kwasowości, zasadowości oraz BZT |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie jest stężenie procentowe roztworu uzyskanego poprzez rozpuszczenie 25 g jodku potasu w 100 cm3 destylowanej wody (o gęstości 1 g/cm3)?
Podstawowy zestaw do filtracji składa się ze statywu oraz
Piktogram ukazujący czaszkę oraz skrzyżowane kości piszczelowe jest typowy dla substancji o działaniu
Najwyżej czyste odczynniki chemiczne to odczynniki
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W wyniku analizy sitowej próbki stałej otrzymano frakcję o średnicy ziaren 12 – 30 mm. Jaką masę powinna mieć prawidłowo pobrana próbka pierwotna?
| Tabela. Wielkość próbki pierwotnej w zależności od wielkości ziarna | ||||
|---|---|---|---|---|
| Średnica ziaren lub kawałków [mm] | do 1 | 1 - 10 | 11 - 50 | ponad 50 |
| Pierwotna próbka (minimum) [g] | 100 | 200 | 1000 | 2500 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wskaż, do jakiego typu należą zamieszczone równania reakcji.
| I. 2 Mg + O2 → 2 MgO |
| II. 2 KMnO4 → K2MnO4 + MnO2 + O2 |
| III. BaCl2 + H2SO4→ BaSO4 + 2 HCl |
Co oznacza skrót AKT?
Jak nazywa się proces, w którym następuje wytrącenie ciała stałego z przesyconego roztworu w wyniku spadku temperatury?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W laboratorium chemicznym przewody instalacji rurowych są oznaczane różnymi kolorami, zgodnie z obowiązującymi normami. Polska Norma PN-70 N-01270/30 określa kolor dla wody jako
Podczas reakcji chlorku żelaza(III) z wodorotlenkiem potasu dochodzi do wytrącenia wodorotlenku żelaza(III) w formie
Proces przesiewania próbki prowadzi się za pomocą urządzenia przedstawionego na rysunku
| Tabela. Sposoby utrwalania próbek wody i ścieków, miejsce analizy, dopuszczalny czas przechowywania próbek | ||||
|---|---|---|---|---|
| Oznaczany parametr | Rodzaj naczynia do przechowywania próbki | Sposób utrwalania próbki | Miejsce wykonania analizy | Dopuszczalny czas przechowywania próbki |
| Chlorki | szklane lub polietylenowe | - | laboratorium | 96 godzin |
| Chlor pozostały | szklane | - | w miejscu pobrania próbki | - |
| ChZT | szklane | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 24 godziny |
| Kwasowość | szklane lub polietylenowe | schłodzenie do temperatury 2-5°C | laboratorium | 4 godziny |
| Mangan | szklane lub polietylenowe | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 48 godzin |
Z uwagi na bezpieczeństwo pracy, ciecze żrące powinny być podgrzewane w łaźniach
Jakim kolorem zazwyczaj oznacza się przewody w instalacji gazowej w laboratorium?
Analiza technicznego kwasu solnego dała następujące wyniki: 30% HCl, 0,008% H2SO4, 0,04% Fe.
Korzystając z zamieszczonej tabeli wymagań, określ gatunek kwasu, pamiętając, że decyduje o nim najgorszy wskaźnik.
| Wymagania chemiczne dotyczące kwasu siarkowego | ||||
| Wymagania | Gatunki | |||
| I | II | III | IV | |
| Chlorowodór, % | > 33 | > 29 | > 28 | > 27 |
| Kwas siarkowy(VI) w przel. na SO42-, % | < 0,009 | < 0,5 | < 1,6 | < 1,8 |
| Żelazo (Fe3+), % | < 0,005 | < 0,03 | < 0,03 | < 0,05 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby uzyskać drobnokrystaliczny osad BaSO4, należy wykonać poniższe kroki:
Do zlewki wlać 20 cm3 roztworu BaCl2, następnie dodać 100 cm3 wody destylowanej oraz kilka kropli roztworu HCl. Zawartość zlewki podgrzać na łaźni wodnej, a potem, ciągle mieszając, dodać 35 cm3 roztworu H2SO4.
Mieszaninę ogrzewać na łaźni wodnej przez 1 godzinę. Osad odsączyć i przepłukać kilkakrotnie gorącą wodą zakwaszoną kilkoma kroplami roztworu H2SO4.
Według przedstawionej procedury, do uzyskania osadu BaSO4 potrzebne są:
Na ilustracji zobrazowano urządzenie do
Aby wykonać czynności analityczne wskazane w ramce, należy użyć:
| Otrzymaną do badań próbkę badanego roztworu rozcieńczyć wodą destylowaną w kolbie miarowej o pojemności 100 cm3 do kreski i dokładnie wymieszać. Następnie przenieść pipetą 10 cm3 tego roztworu do kolby stożkowej, dodać ok. 50 cm3 wody destylowanej. |
Aby otrzymać roztwór AgNO3 (masa molowa AgNO3 to 169,8 g/mol) o stężeniu 0,1 mol/dm3, należy
Do pojemników na odpady stałe, które są przeznaczone do utylizacji, nie można wprowadzać bezpośrednio cyjanków oraz związków kompleksowych zawierających jony cyjankowe z powodu
W wyniku rozkładu 100 g węglanu wapnia, otrzymano 25 g tlenku wapnia. Wydajność procentowa reakcji wynosi
| MCaCO3 = 100g / mol | MCaO = 56g / mol |
Nie należy podgrzewać cieczy w szczelnie zamkniętych pojemnikach, ponieważ
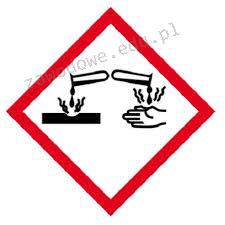
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?