Pytanie 1
W tabeli zamieszczono temperatury wrzenia niektórych składników powietrza. Na podstawie tych danych podaj, który ze składników oddestyluje jako ostatni.
| Temperatura wrzenia °C | Składniki |
|---|---|
| -245,9 | Neon |
| -182,96 | Tlen |
| -195,8 | Azot |
| -185,7 | Argon |
Wynik: 34/40 punktów (85,0%)
Wymagane minimum: 20 punktów (50%)
W tabeli zamieszczono temperatury wrzenia niektórych składników powietrza. Na podstawie tych danych podaj, który ze składników oddestyluje jako ostatni.
| Temperatura wrzenia °C | Składniki |
|---|---|
| -245,9 | Neon |
| -182,96 | Tlen |
| -195,8 | Azot |
| -185,7 | Argon |
Który z poniższych sposobów homogenizacji próbki jest najbardziej odpowiedni do przygotowania próbki gleby do analizy chemicznej?
Nie należy używać do czyszczenia szklanych naczyń laboratoryjnych
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie jest stężenie molowe kwasu siarkowego(VI) o zawartości 96% i gęstości 1,84 g/cm3?
Skrót "cz." na etykiecie odczynnika chemicznego wskazuje, że
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Odczynnik, który w specyficznych warunkach reaguje wyłącznie z danym jonem, umożliwiając tym samym jego identyfikację w mieszance, to odczynnik
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który symbol literowy umieszczany na naczyniach miarowych wskazuje na kalibrację do "wlewu"?
Gdzie należy przechowywać cyjanek potasu KCN?
Aby przygotować 500 cm3 roztworu KMnO4 (M = 158 g/mol) o stężeniu 0,02 mol/dm3, ile należy zważyć?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Zgodnie z danymi zawartymi w tabeli wskaźników roztwór obojętny będzie miał barwę
| Wskaźnik | Zakres zmiany barwy (w jednostkach pH) | Barwa w środowisku | |
|---|---|---|---|
| kwaśnym | zasadowym | ||
| błękit tymolowy | 1,2 – 2,8 | czerwona | żółta |
| oranż metylowy | 3,1 – 4,4 | czerwona | żółta |
| czerwień metylowa | 4,8 – 6,0 | czerwona | żółta |
| czerwień chlorofenolowa | 5,2 – 6,8 | żółta | czerwona |
| błękit bromotymolowy | 6,0 – 7,6 | żółta | niebieska |
| czerwień fenolowa | 6,6 – 8,0 | żółta | czerwona |
| błękit tymolowy | 8,0 – 9,6 | żółta | niebieska |
| fenoloftaleina | 8,2 – 10,0 | bezbarwna | czerwona |
| żółcień alizarynowa | 10,1 – 12,0 | żółta | zielona |
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
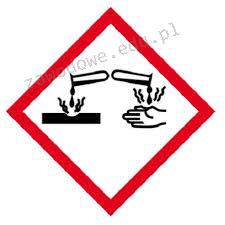
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby odcedzić galaretowaty osad, konieczne jest użycie sączka
W którym wierszu są zapisane nazwy wyłącznie rozpuszczalników palnych?
| Właściwości wybranych rozpuszczalników. | ||||
|---|---|---|---|---|
| Rozpuszczalnik | Gęstość [g/cm3] | Temperatura wrzenia [°C] | Temperatura zapłonu [°C] | Rozpuszczalność w wodzie [g/100 cm3] |
| Eter dietylowy | 0,71 | 35 | -45 | 7 |
| Heksan | 0,66 | 60-80 | -23 | 0,01 |
| Aceton | 0,79 | 57 | -18 | ∞ |
| Benzen | 0,88 | 80 | -11 | 0,07 |
| Chloroform | 1,49 | 61 | - | 0,82 |
| Tetrachlorometan | 1,59 | 77 | - | 0,08 |
| Etanol | 0,81 | 78 | 12 | ∞ |
| Chlorometan | 1,34 | 41 | - | 2 |
Do 300 g wody o temperaturze 30oC dodano 120 g substancji, co zaowocowało powstaniem roztworu nasyconego. Jaką ma rozpuszczalność ta substancja w temperaturze 30oC?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Próbkę uzyskaną z próbki ogólnej poprzez jej zmniejszenie nazywa się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Stosunek masowy miedzi do siarki w siarczku miedzi(I) wynosi
| 16S Siarka 32 | 29Cu Miedź 63,55 |
Materiały wykorzystywane w laboratoriach, mogące prowadzić do powstawania mieszanin wybuchowych, powinny być przechowywane
250 cm3 roztworu kwasu octowego o stężeniu 10% objętościowych zostało rozcieńczone pięciokrotnie. Jakie jest stężenie otrzymanego roztworu?
Rozpuszczalniki organiczne powinny być składowane
Połączono równe ilości cynku i bromu, a następnie poddano je reakcji Zn + Br2 → ZnBr2. W tych warunkach stopień reakcji cynku wynosi (masy atomowe: Zn – 65u, Br – 80u)?
Mianowanie roztworu KMnO4 następuje według poniższej procedury:
Około 0,2 g szczawianu sodu, ważonego z dokładnością ±0,1 mg, przenosi się do kolby stożkowej, rozpuszcza w około 100 cm3 wody destylowanej, następnie dodaje się 10 cm3 roztworu kwasu siarkowego(VI) i podgrzewa do temperatury około 70 °C. Miareczkowanie przeprowadza się roztworem KMnO4 do momentu uzyskania trwałego, jasnoróżowego koloru.
Powyższa procedura odnosi się do miareczkowania
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Które z wymienionych reakcji chemicznych stanowi reakcję redoks?
Kalibracja pH-metru nie jest potrzebna po