Pytanie 1
Które z poniższych równań ilustruje reakcję, w której powstają produkty gazowe?
Wynik: 24/40 punktów (60,0%)
Wymagane minimum: 20 punktów (50%)
Które z poniższych równań ilustruje reakcję, w której powstają produkty gazowe?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Fragment procedury analitycznej
(...) Przenieś badany roztwór całkowicie do rozdzielacza gruszkowego o pojemności od 50 do 100 cm3, dodaj 5 cm3 roztworu tiocyjanianu potasu oraz 10 cm3 alkoholu izopentylowego, a następnie wstrząsaj zawartością przez 30 sekund.
Po rozdzieleniu faz przenieś roztwór wodny do drugiego rozdzielacza, natomiast fazę organiczną do suchej kolbki miarowej o pojemności 50 cm3(...) Który rodzaj ekstrakcji jest opisany w powyższym fragmencie?
W wyniku analizy sitowej próbki stałej otrzymano frakcję o średnicy ziaren 12 – 30 mm. Jaką masę powinna mieć prawidłowo pobrana próbka pierwotna?
| Tabela. Wielkość próbki pierwotnej w zależności od wielkości ziarna | ||||
|---|---|---|---|---|
| Średnica ziaren lub kawałków [mm] | do 1 | 1 - 10 | 11 - 50 | ponad 50 |
| Pierwotna próbka (minimum) [g] | 100 | 200 | 1000 | 2500 |
Na skutek krystalizacji 18 g kwasu benzoesowego uzyskano 8 g czystego produktu. Jaką wydajność miała ta krystalizacja?
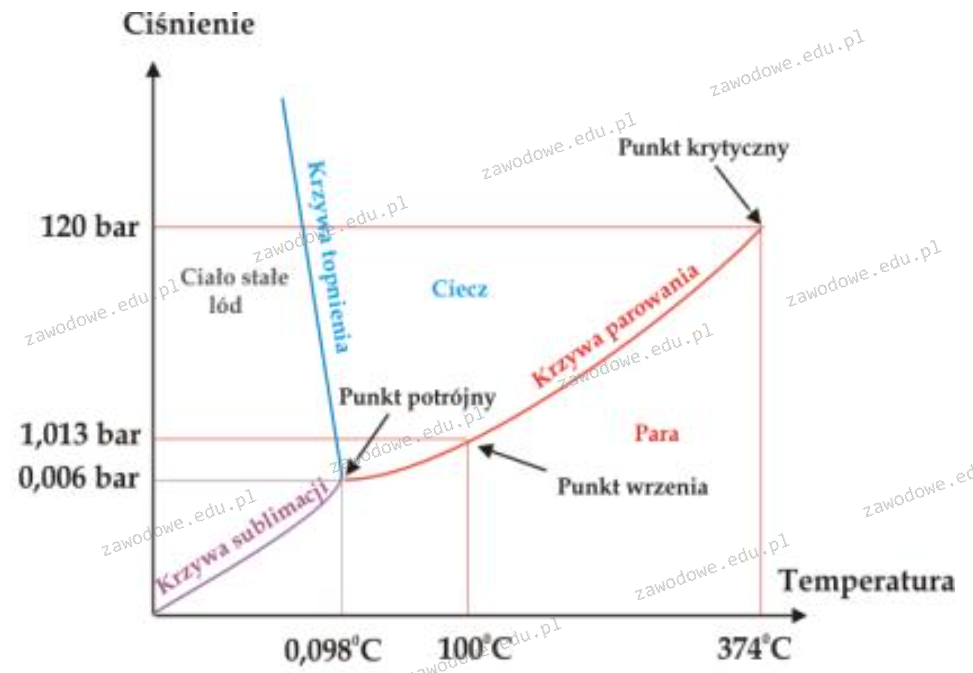
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Aby przygotować 200 g roztworu chlorku potasu o stężeniu 5% (m/m), ile substancji należy zastosować?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Substancje kancerogenne to
Jednym z sposobów oddzielania jednorodnych mieszanin jest
Proces, w którym woda jest usuwana z zamrożonego materiału poprzez sublimację lodu
(czyli bezpośrednie przejście do stanu pary z pominięciem stanu ciekłego) nazywa się
Aby wykonać chromatografię cienkowarstwową, należy przygotować eluent składający się z toluenu, acetonu oraz kwasu mrówkowego w proporcjach objętościowych 10:4:1. Jakie ilości poszczególnych składników powinny być wykorzystane do uzyskania 300 cm3 eluentu?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie środki ochronne należy zastosować podczas sporządzania 1M roztworu zasady sodowej ze stężonego roztworu NaOH, na opakowaniu którego widnieje oznaczenie S/36/37/39?
| Numer zwrotu S | Warunki bezpiecznego stosowania |
|---|---|
| S36 | Używać odpowiedniej odzieży ochronnej |
| S37 | Używać odpowiednich rękawic |
| S38 | W przypadku niewystarczającej wentylacji używać sprzętu do oddychania |
| S39 | Używać okularów lub maski ochronnej |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Zestaw do filtracji nie zawiera
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W laboratoriach roztwór potasu dichromianu(VI) w stężonym kwasie siarkowym(VI) wykorzystuje się do
Zgodnie z instrukcją dotyczącą pobierania próbek nawozów (na podstawie normy PN-EN 12579:2001), liczbę punktów pobierania próbek pierwotnych ustala się według wzoru nsp = 0,5·√V, gdzie V oznacza objętość jednostki badanej w m3. Wartość nsp zaokrągla się do liczby całkowitej, a dodatkowo nie może być mniejsza niż 12 ani większa niż 30.
Dlatego dla objętości V = 4900 m3, nsp wynosi
Na podstawie informacji zawartej na pipecie, została ona skalibrowana na
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do filtracji osadów drobnokrystalicznych wykorzystuje się filtry
Na podstawie danych w tabeli próbkę, w której będzie oznaczany BZT, należy przechowywać
| Oznaczany parametr | Rodzaj naczynia do przechowywania | Sposób utrwalania | Dopuszczalny czas przechowywania |
|---|---|---|---|
| barwa | szklane lub polietylenowe | - schłodzenie do temperatury 2-5°C | 24 h |
| fosforany ogólne | szklane lub polietylenowe | - zakwaszenie kwasem siarkowym(VI) - schłodzenie do temperatury 2-5°C | 4 h 48 h |
| BZT | szklane | - schłodzenie do temperatury 2-5°C - przechowywanie w ciemności | 24 h |
| azot azotanowy(V) | szklane lub polietylenowe | - schłodzenie do temperatury 2-5°C - dodanie 2 cm3 chloroformu do 1 dm3 próbki | 24 h 48 h |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Ile gramów 80% kwasu mrówkowego trzeba zważyć, aby uzyskać 200 g 20% roztworu tego kwasu?
Jaką objętość zasady sodowej o stężeniu 1,0 mol/dm3 należy dodać do 56,8 g kwasu stearynowego, aby otrzymać mydło sodowe (stearynian sodu)?
| C17H35COOH + NaOH → C17H35COONa + H2O |
| (MC17H35COOH = 284 g/mol, MC17H35COONa = 306 g/mol, MNaOH = 40 g/mol, MH2O= 18 g/mol) |
Sposoby utrwalania i przechowywania próbek wody przeznaczonych do badań fizykochemicznych.
Próbkę wody przeznaczoną do oznaczenia zawartości metali poddaje się utrwalaniu za pomocą
| Oznaczenie | Sposób utrwalania i przechowywania |
|---|---|
| Barwa | Przechowywać w ciemności |
| Mętność | Przechowywać w ciemności |
| Twardość | pH = 3 z użyciem HNO3 |
| OWO | 0,7 ml HCl/30 ml próbki |
| ChZT | pH 1- 2 z użyciem H2SO4 |
| Fosfor | Przechowywać w temperaturze 1-5°C |
| Glin | pH 1-2 z użyciem HNO3 |
| Żelazo | pH 1-2 z użyciem HNO3 |
| Utlenialność | pH1-2 z użyciem H2SO4, Przechowywać w ciemności |
Ile gramów chlorku baru powinno się rozpuścić w wodzie, aby uzyskać 200 cm3 roztworu o stężeniu 10% i gęstości 1,203 g/cm3?
Mianowanie roztworu o stężeniu przybliżonym można wykonać poprzez
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do grupy reagentów o szczególnym zastosowaniu nie wlicza się
Wskaż zbiór substancji, które po rozpuszczeniu w wodzie stają się elektrolitami?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Którą substancję można bezpośrednio wyrzucić do odpadów komunalnych?
Aby przygotować 150 g roztworu jodku potasu o stężeniu 10% (m/m), konieczne jest użycie
(zakładając, że gęstość wody wynosi 1 g/cm3)
W trakcie kalibracji stężenia roztworu kwasu solnego na przynajmniej przygotowany roztwór zasady sodowej ma miejsce reakcja
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.