Pytanie 1
Eliminacja substancji organicznych z próbki poprzez jej spalenie nazywa się
Wynik: 25/40 punktów (62,5%)
Wymagane minimum: 20 punktów (50%)
Eliminacja substancji organicznych z próbki poprzez jej spalenie nazywa się
W tabeli zestawiono objętości molowe czterech gazów odmierzone w warunkach normalnych.
Dla którego spośród wymienionych w tabeli gazów objętość molowa najbardziej odchyla się od wartości obliczonej dla gazu doskonałego?
| Gaz | SO2 | CHCl3(para) | O3 | NH3 |
|---|---|---|---|---|
| Objętość molowa (dm3/mol) | 21,89 | 22,60 | 21,6 | 22,08 |
Wykorzystując pipetę gazową, pobrano próbkę azotu (Mn2 = 28 g/mol) o objętości 250 cm3 w standardowych warunkach. Jaką masę ma zmierzony azot?
Ile gramów cukru trzeba dodać do 200 gramów wody o temperaturze 20°C, aby uzyskać roztwór nasycony?
Aby przygotować 500 g roztworu o stężeniu 10% (m/m), ile substancji należy odważyć?
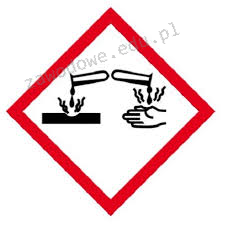
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
Oblicz, jaką ilość węglanu sodu w gramach należy przygotować, aby uzyskać 500 cm3 roztworu tej soli o stężeniu 0,1000 mol/dm3.
MNa = 23 g/mol, MC = 12 g/mol, MO = 16 g/mol
Ustalanie miana roztworu polega na
Komora przeszklona w formie dużej szafy, wyposażona w wentylator, która zapobiega wydostawaniu się szkodliwych substancji do atmosfery laboratorium oraz chroni przed pożarami i eksplozjami, to
Korzystając z danych w tabeli wskaż, ile cm3 36% roztworu HCl należy użyć, aby przygotować 250 cm3 0,1-molowego roztworu tego kwasu.
| % wagowy [%] | d420 [g/cm3] | m HCl w 100 cm3 [g/100cm3] | CM HCl [mol/dm3] |
|---|---|---|---|
| 30 | 1,1492 | 34,48 | 9,46 |
| 32 | 1,1593 | 37,10 | 10,17 |
| 34 | 1,1691 | 39,75 | 10,90 |
| 36 | 1,1789 | 42,44 | 11,64 |
Podczas przewozu próbek wody, które mają być badane pod kątem właściwości fizykochemicznych, zaleca się, aby te próbki były
Aby przygotować mianowany roztwór KMnO4, należy odważyć wysuszone Na2C2O4 o masie zbliżonej do 250 mg, z dokładnością wynoszącą 1 mg. Jaką masę powinna mieć prawidłowo przygotowana odważka?
Po połączeniu 50 cm3 wody z 50 cm3 alkoholu etylowego, objętość otrzymanej mieszanki jest poniżej 100 cm3. Zjawisko to jest spowodowane
Zabieg, który wykonuje się podczas pobierania próbki wody do analizy, mający na celu zachowanie jej składu chemicznego w trakcie transportu, określa się mianem
Który z etapów przygotowania próbek do analizy opisano w ramce?
| Proces polegający na usuwaniu wody z zamrożonego materiału na drodze sublimacji lodu, tzn. bezpośredniego jego przejścia w stan pary z pominięciem stanu ciekłego. |
W celu przygotowania 100 cm3 roztworu mianowanego, jaką kolbę należy zastosować?
Aby uzyskać całkowicie bezwodny Na2CO3, przeprowadzono prażenie 143 g Na2CO3·10H2O (M = 286 g/mol). Po upływie zalecanego czasu prażenia odnotowano utratę masy 90 g. W związku z tym prażenie należy
Aby przyspieszyć reakcję, należy zwiększyć stężenie substratów
Do pojemników na odpady stałe, które są przeznaczone do utylizacji, nie można wprowadzać bezpośrednio cyjanków oraz związków kompleksowych zawierających jony cyjankowe z powodu
Do kolby destylacyjnej wprowadzono 200 cm3 zanieczyszczonego acetonu o gęstości d = 0,9604 g/cm3 oraz czystości 90% masowych. W celu oczyszczenia przeprowadzono proces destylacji, w wyniku czego uzyskano 113,74 g czystego acetonu. Jakie były straty acetonu podczas destylacji?
W próbkach obecne są składniki, które znacznie różnią się pod względem zawartości. Składnik, którego procentowy udział w próbce jest niższy od 0,01%, nazywamy
W trakcie reakcji estryfikacji opisanej równaniem CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O użyto molowego stosunku alkoholu do kwasu wynoszącego 1:10. W rezultacie tego
Wskaż, do jakiego typu należą zamieszczone równania reakcji.
| I. 2 Mg + O2 → 2 MgO |
| II. 2 KMnO4 → K2MnO4 + MnO2 + O2 |
| III. BaCl2 + H2SO4→ BaSO4 + 2 HCl |
Aby przygotować 200 g roztworu chlorku potasu o stężeniu 5% (m/m), ile substancji należy zastosować?
Oblicz masę wapienia, który został rozłożony, jeśli w trakcie reakcji uzyskano 44,8 dm3 CO2 (w warunkach standardowych).
MC = 12 g/mol, MCa = 40 g/mol, MO = 16 g/mol
Jakim kolorem zazwyczaj oznacza się przewody w instalacji gazowej w laboratorium?
250 cm3 roztworu kwasu octowego o stężeniu 10% objętościowych zostało rozcieńczone pięciokrotnie. Jakie jest stężenie otrzymanego roztworu?
W tabeli przestawiono dane dotyczące wybranych roztworów wodnych wodorotlenku sodu.
Oblicz masę wodorotlenku sodu, jaką należy rozpuścić w 200,0 cm3 wody, aby otrzymać roztwór o gęstości 1,0428 g/cm3.
| d420 [g/cm3] | masa NaOH [g/100 cm3] |
|---|---|
| 1,0095 | 1,01 |
| 1,0207 | 2,04 |
| 1,0428 | 4,17 |
| 1,0648 | 6,39 |
| 1,0869 | 8,70 |
| 1,1089 | 11,09 |
Naczynia miarowe kalibrowane "na wlew" mają oznaczenie w postaci symbolu
Czystość konkretnego odczynnika chemicznego wynosi: 99,9-99,99%. Jakiego rodzaju jest ten odczynnik?
W przypadku rozlania żrącego odczynnika chemicznego na skórę pierwszym poprawnym działaniem jest:
Aby zebrać próbki gazów, wykorzystuje się
W celu usunięcia drobnych zawiesin z roztworu przed analizą spektrofotometryczną stosuje się:
Aby otrzymać 200 g roztworu siarczanu(VI) sodu o stężeniu 12%, należy wykorzystać
(Na – 23 g/mol; S – 32 g/mol; H – 1 g/mol; O – 16 g/mol)
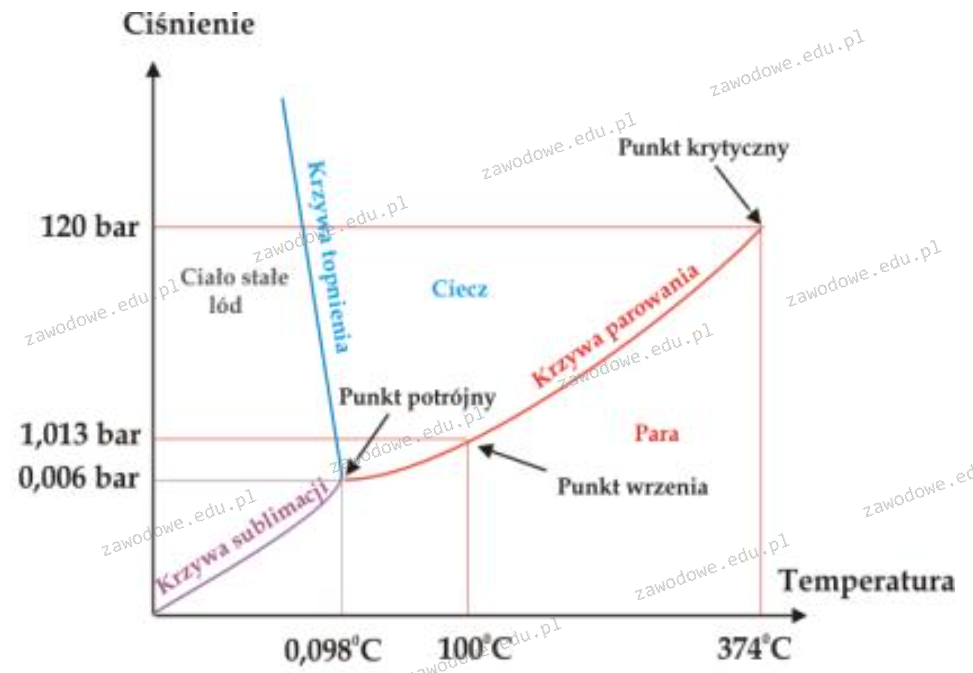
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
W nieopisanej butelce prawdopodobnie znajduje się roztwór zasadowy. Wskaż odczynnik, który pozwoli to zweryfikować?
W którym wierszu są zapisane nazwy wyłącznie rozpuszczalników palnych?
| Właściwości wybranych rozpuszczalników. | ||||
|---|---|---|---|---|
| Rozpuszczalnik | Gęstość [g/cm3] | Temperatura wrzenia [°C] | Temperatura zapłonu [°C] | Rozpuszczalność w wodzie [g/100 cm3] |
| Eter dietylowy | 0,71 | 35 | -45 | 7 |
| Heksan | 0,66 | 60-80 | -23 | 0,01 |
| Aceton | 0,79 | 57 | -18 | ∞ |
| Benzen | 0,88 | 80 | -11 | 0,07 |
| Chloroform | 1,49 | 61 | - | 0,82 |
| Tetrachlorometan | 1,59 | 77 | - | 0,08 |
| Etanol | 0,81 | 78 | 12 | ∞ |
| Chlorometan | 1,34 | 41 | - | 2 |
Wszystkie pojemniki z odpadami, zarówno stałymi, jak i ciekłymi, które są przekazywane do służby zajmującej się utylizacją, powinny być opatrzone informacjami
Do 200 g roztworu NaOH (M = 40 g/mol) o stężeniu 10 % dodano wodę destylowaną w kolbie miarowej o pojemności 500 cm3 do znaku. Jakie jest stężenie molowe powstałego roztworu?
Próbka, której celem jest ustalenie poziomu składników, dla których oznaczenia przygotowane przez różne laboratoria są niezgodne, to próbka