Pytanie 1
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wynik: 31/40 punktów (77,5%)
Wymagane minimum: 20 punktów (50%)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Komora przeszklona w formie dużej szafy, wyposażona w wentylator, która zapobiega wydostawaniu się szkodliwych substancji do atmosfery laboratorium oraz chroni przed pożarami i eksplozjami, to
Próbka pobrana z próbki ogólnej, która odzwierciedla cechy partii produktu, określa się jako próbka
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby wykonać chromatografię cienkowarstwową, należy przygotować eluent składający się z toluenu, acetonu oraz kwasu mrówkowego w proporcjach objętościowych 10:4:1. Jakie ilości poszczególnych składników powinny być wykorzystane do uzyskania 300 cm3 eluentu?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby przygotować 500 cm3 roztworu KMnO4 (M = 158 g/mol) o stężeniu 0,02 mol/dm3, ile należy zważyć?
Który z etapów przygotowania próbek do analizy opisano w ramce?
| Proces polegający na usuwaniu wody z zamrożonego materiału na drodze sublimacji lodu, tzn. bezpośredniego jego przejścia w stan pary z pominięciem stanu ciekłego. |
Do metalowego sprzętu laboratoryjnego używanego w praktykach analitycznych zalicza się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Zamieszczony piktogram przedstawia substancję o klasie i kategorii zagrożenia:

Aby odróżnić urządzenia w laboratorium chemicznym, rury do próżni maluje się w kolorze
Wskaż metodę rozdzielenia układu, w którym fazą rozproszoną jest ciało stałe, a fazą rozpraszającą gaz.
| faza rozproszona | faza rozpraszająca | ||
|---|---|---|---|
| gaz | ciecz | ciało stałe | |
| gaz | - | piana | piana stała |
| ciecz | aerozol ciekły | emulsja | emulsja stała |
| ciało stałe | aerozol stały | zol | zol stały |
Aby przeprowadzić analizę jakościową, próbkę mosiądzu należy roztworzyć w stężonym kwasie
Jaką objętość zasady sodowej o stężeniu 1,0 mol/dm3 należy dodać do 56,8 g kwasu stearynowego, aby otrzymać mydło sodowe (stearynian sodu)?
| C17H35COOH + NaOH → C17H35COONa + H2O |
| (MC17H35COOH = 284 g/mol, MC17H35COONa = 306 g/mol, MNaOH = 40 g/mol, MH2O= 18 g/mol) |
Którego związku chemicznego, z uwagi na jego silne właściwości higroskopijne, nie powinno się używać w analizie miareczkowej jako substancji podstawowej?
Reakcja neutralizacji wodorotlenku sodu z kwasem solnym zrealizowana jest zgodnie z równaniem:
NaOH + HCl → NaCl + H2O Masy molowe: MNaOH = 40 g/mol, MHCl = 36,5 g/mol Aby zneutralizować 10 g wodorotlenku sodu, wymagane jest
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Pierwotna próbka jest zbierana
W laboratorium chemicznym systemy wodne zazwyczaj oznacza się kolorem zielonym
W trakcie reakcji estryfikacji opisanej równaniem CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O użyto molowego stosunku alkoholu do kwasu wynoszącego 1:10. W rezultacie tego
Sód powinien być przechowywany
Jakiego koloru nabierze lakmus w roztworze NaOH?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Urządzenie pokazane na ilustracji jest przeznaczone do
Proces mineralizacji próbki, który polega na jej spopieleniu w piecu muflowym w temperaturze 300-500°C i rozpuszczeniu pozostałych resztek w kwasach w celu oznaczenia zawartości metali ciężkich, to mineralizacja
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby przygotować zestaw do filtracji, należy zebrać
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby odcedzić galaretowaty osad, konieczne jest użycie sączka
Jaką objętość roztworu NaOH o stężeniu 1 mol/dm3 należy użyć, aby przygotować 50 cm3 roztworu NaOH o stężeniu 0,4 mol/dm3?
Z kolby miarowej o pojemności 1 dm3, zawierającej roztwór HCl o stężeniu 0,1 mol/dm3, pobrano pipetą 2,5 cm3, a następnie przeniesiono do kolby miarowej o pojemności 20 cm3 i rozcieńczono wodą "do kreski" miarowej. Jakie stężenie ma otrzymany roztwór?
Co oznacza zapis cz.d.a. na etykiecie opakowania odczynnika chemicznego?
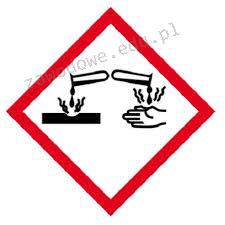
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Aby otrzymać 200 g roztworu siarczanu(VI) sodu o stężeniu 12%, należy wykorzystać
(Na – 23 g/mol; S – 32 g/mol; H – 1 g/mol; O – 16 g/mol)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Czego się używa w produkcji z porcelany?
Niemetal o kolorze fioletowoczarnym, który łatwo przechodzi w stan gazowy, to