Pytanie 1
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wynik: 37/40 punktów (92,5%)
Wymagane minimum: 20 punktów (50%)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Czy próbkę laboratoryjną przechowuje się w lodówce, gdy występuje w niej
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Resztki szkła, osadników czy inne odpady stałe powstałe w laboratorium analitycznym powinny być umieszczone
Czy odpady laboratoryjne zawierające jony metali ciężkich powinny zostać poddane obróbce przed umieszczeniem ich w odpowiednio oznaczonej pojemności?
Eliminacja substancji organicznych z próbki poprzez jej spalenie nazywa się
W trakcie destylacji cieczy wykorzystuje się tzw. kamienie wrzenne, ponieważ
Odpady, które w przeważającej mierze składają się z osadów siarczków metali ciężkich, nazywa się
Metodą, która nie umożliwia przeniesienia składników próbki do roztworu, jest
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Próbkę laboratoryjną dzieli się na dwie części, ponieważ
300 cm3 zanieczyszczonego benzenu poddano procesowi destylacji. Uzyskano 270 cm3 czystej substancji. Jaką wydajność miało oczyszczanie?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Deminimalizowaną wodę można uzyskać przez
Po rozpuszczeniu substancji w kolbie miarowej, należy odczekać przed dopełnieniem jej wodą "do kreski" miarowej. Taki sposób postępowania jest uzasadniony
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaką objętość w warunkach standardowych zajmie 1,7 g amoniaku (masa molowa amoniaku wynosi 17 g/mol)?
W laboratorium chemicznym przewody instalacji rurowych są oznaczane różnymi kolorami, zgodnie z obowiązującymi normami. Polska Norma PN-70 N-01270/30 określa kolor dla wody jako
Jakim kolorem zazwyczaj oznacza się przewody w instalacji gazowej w laboratorium?
W celu usunięcia drobnych zawiesin z roztworu przed analizą spektrofotometryczną stosuje się:
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Oblicz stężenie molowe 250 cm3 roztworu NaOH, w którym znajduje się 0,5 g substancji. Masa molowa NaOH wynosi 40 g/mol
Jakie jest stężenie procentowe roztworu HCl (M=36,46 g/mol) o gęstości 1,19 g/cm3 oraz stężeniu molowym 12 mol/dm3?
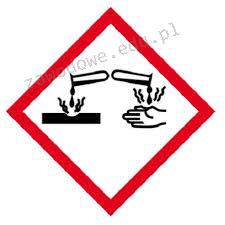
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Zestaw do filtracji nie zawiera
Po połączeniu 50 cm3 wody z 50 cm3 alkoholu etylowego, objętość otrzymanej mieszanki jest poniżej 100 cm3. Zjawisko to jest spowodowane
Wybór lokalizacji do poboru próbek wody z rzeki nie jest uzależniony od
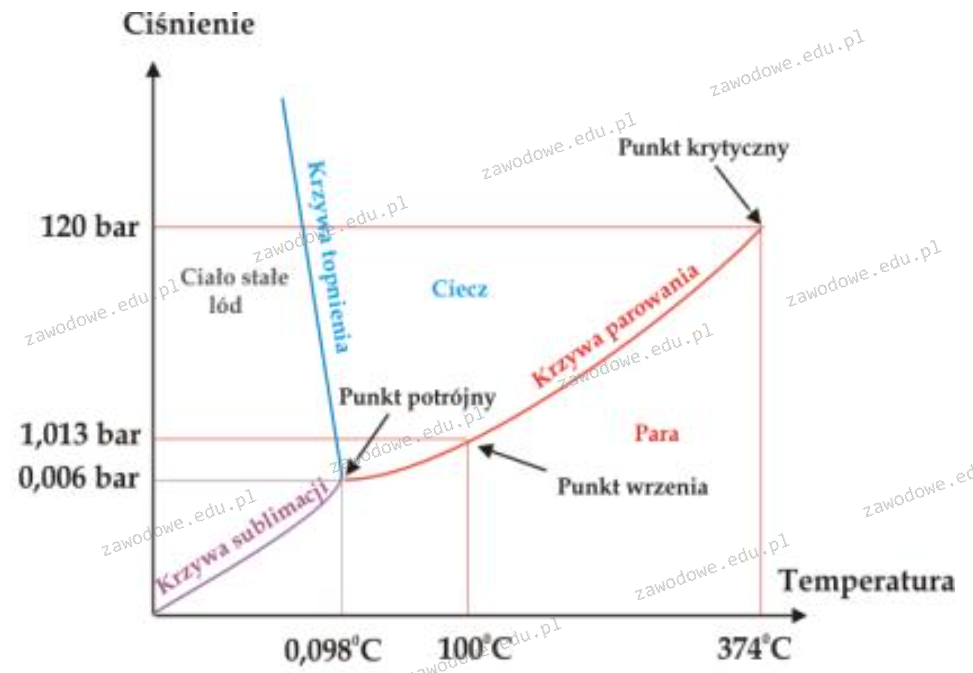
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Reakcja miedzi metalicznej z stężonym kwasem azotowym(V) prowadzi do powstania azotanu(V) miedzi(II) oraz jakiego związku?
Aby wykonać czynności analityczne wskazane w ramce, należy użyć:
| Otrzymaną do badań próbkę badanego roztworu rozcieńczyć wodą destylowaną w kolbie miarowej o pojemności 100 cm3 do kreski i dokładnie wymieszać. Następnie przenieść pipetą 10 cm3 tego roztworu do kolby stożkowej, dodać ok. 50 cm3 wody destylowanej. |
Rozpuszczalność siarczanu(VI) potasu przy temperaturze 30oC wynosi 13 g na 100 g wody. Jaką masę tego związku należy dodać do wody, aby uzyskać 500 g roztworu nasyconego?
Na podstawie informacji zawartych w tabeli wskaż mieszaninę oziębiającą o temperaturze -21 °C.
| Temperatura mieszaniny | Skład mieszaniny | Stosunek masowy |
| -15 °C | lód + octan sodu | 10:9 |
| -18 °C | lód + chlorek amonu | 10:3 |
| -21 °C | lód + chlorek sodu | 3:1 |
| -25 °C | lód + azotan amonu | 1:9 |
Materiał uzyskany przez zmieszanie prób pobranych w ustalonych odstępach czasu określa się mianem próbki
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wskaź sprzęt konieczny do przeprowadzenia miareczkowania?
Z uwagi na bezpieczeństwo pracy, ciecze żrące powinny być podgrzewane w łaźniach
Odpady z rozpuszczalników organicznych, takich jak benzen czy aceton, zawierające co najmniej 80% danego rozpuszczalnika, należy
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.