Pytanie 1
Aspirator jest urządzeniem wykorzystywanym do pobierania próbek
Wynik: 37/40 punktów (92,5%)
Wymagane minimum: 20 punktów (50%)
Aspirator jest urządzeniem wykorzystywanym do pobierania próbek
Aby wykonać czynności analityczne wskazane w ramce, należy użyć:
| Otrzymaną do badań próbkę badanego roztworu rozcieńczyć wodą destylowaną w kolbie miarowej o pojemności 100 cm3 do kreski i dokładnie wymieszać. Następnie przenieść pipetą 10 cm3 tego roztworu do kolby stożkowej, dodać ok. 50 cm3 wody destylowanej. |
Użycie płuczek jest konieczne w trakcie procesu
Aby ustalić miano roztworu wodnego NaOH, należy zastosować
Na podstawie informacji zawartych w tabeli określ, który parametr spośród podanych należy oznaczyć w pierwszej kolejności.
| Tabela. Sposoby utrwalania próbek wody i ścieków, miejsce analizy, dopuszczalny czas przechowywania próbek | ||||
|---|---|---|---|---|
| Oznaczany parametr | Rodzaj naczynia do przechowywania próbki | Sposób utrwalania próbki | Miejsce wykonania analizy | Dopuszczalny czas przechowywania próbki |
| Chlorki | szklane lub polietylenowe | - | laboratorium | 96 godzin |
| Chlor pozostały | szklane | - | w miejscu pobrania próbki | - |
| ChZT | szklane | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 24 godziny |
| Kwasowość | szklane lub polietylenowe | schłodzenie do temperatury 2-5°C | laboratorium | 4 godziny |
| Mangan | szklane lub polietylenowe | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 48 godziny |
W tabeli przestawiono dane dotyczące wybranych roztworów wodnych wodorotlenku sodu.
Oblicz masę wodorotlenku sodu, jaką należy rozpuścić w 200,0 cm3 wody, aby otrzymać roztwór o gęstości 1,0428 g/cm3.
| d420 [g/cm3] | masa NaOH [g/100 cm3] |
|---|---|
| 1,0095 | 1,01 |
| 1,0207 | 2,04 |
| 1,0428 | 4,17 |
| 1,0648 | 6,39 |
| 1,0869 | 8,70 |
| 1,1089 | 11,09 |
Które z poniższych równań ilustruje reakcję, w której powstają produkty gazowe?
Materiały wykorzystywane w laboratoriach, mogące prowadzić do powstawania mieszanin wybuchowych, powinny być przechowywane
Związki chromu(VI) oddziałują negatywnie na środowisko, ponieważ
Jakie urządzenie wykorzystuje się do pobierania próbek gazów?
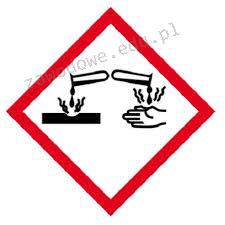
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
W tabeli zestawiono objętości molowe czterech gazów odmierzone w warunkach normalnych.
Dla którego spośród wymienionych w tabeli gazów objętość molowa najbardziej odchyla się od wartości obliczonej dla gazu doskonałego?
| Gaz | SO2 | CHCl3(para) | O3 | NH3 |
|---|---|---|---|---|
| Objętość molowa (dm3/mol) | 21,89 | 22,60 | 21,6 | 22,08 |
Mianowanie roztworu KMnO4 następuje według poniższej procedury:
Około 0,2 g szczawianu sodu, ważonego z dokładnością ±0,1 mg, przenosi się do kolby stożkowej, rozpuszcza w około 100 cm3 wody destylowanej, następnie dodaje się 10 cm3 roztworu kwasu siarkowego(VI) i podgrzewa do temperatury około 70 °C. Miareczkowanie przeprowadza się roztworem KMnO4 do momentu uzyskania trwałego, jasnoróżowego koloru.
Powyższa procedura odnosi się do miareczkowania
W celu rozdrabniania niewielkich ilości bardzo twardego materiału wykorzystuje się moździerze
W wypadku oblania skóry kwasem mrówkowym należy
| Wyciąg z karty charakterystyki Skład: kwas mrówkowy 80%, woda 11-20% Pierwsza pomoc. Po narażeniu przez drogi oddechowe. Natychmiast wezwać lekarza. Po kontakcie ze skórą. Zanieczyszczoną skórę natychmiast przemyć dużą ilością wody. |
Próbka pobrana z próbki ogólnej, która odzwierciedla cechy partii produktu, określa się jako próbka
Którego związku chemicznego, z uwagi na jego silne właściwości higroskopijne, nie powinno się używać w analizie miareczkowej jako substancji podstawowej?
Wodę do badań mikrobiologicznych powinno się pobierać do butelek
Aby przygotować 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3, jaką kolbę miarową o pojemności należy wykorzystać?
Aby otrzymać roztwór AgNO3 (masa molowa AgNO3 to 169,8 g/mol) o stężeniu 0,1 mol/dm3, należy
Aby uniknąć trwałego połączenia szlifowanych części sprzętu laboratoryjnego, co należy zrobić?
Dokonano pomiaru pH dwóch roztworów, uzyskując wartości pH= 2 oraz pH= 5. Wskaźnij poprawnie sformułowany wniosek.
Jaką masę chlorku sodu można znaleźć w 150 g roztworu soli o stężeniu 5% (m/m)?
W laboratorium chemicznym przewody instalacji rurowych są oznaczane różnymi kolorami, zgodnie z obowiązującymi normami. Polska Norma PN-70 N-01270/30 określa kolor dla wody jako
Instrukcja dotycząca przygotowania wzorcowego roztworu NaCl
0,8242 g NaCl, które wcześniej wysuszono w temperaturze 140 °C do stałej masy, należy rozpuścić w kolbie miarowej o pojemności 1 dm3 w wodzie podwójnie destylowanej, a następnie uzupełnić do kreski tym samym rodzajem wody.
Z treści instrukcji wynika, że odpowiednio skompletowany sprzęt wymagany do sporządzenia wzorcowego roztworu NaCl, oprócz naczynia wagowego, powinien zawierać
Na podstawie zmierzonej temperatury topnienia można określić związek organiczny oraz ustalić jego
Jakie zestawienie sprzętu laboratoryjnego wykorzystuje się do filtracji osadów?
Przedstawiono wyciąg z karty charakterystyki substancji chemicznej. Na podstawie informacji zawartej w zamieszczonym fragmencie karty wskaż wzór chemiczny substancji, której można użyć jako materiału neutralizującego lodowaty kwas octowy.
Kwas octowy lodowaty 99,5% Materiały zapobiegające rozprzestrzenianiu się skażenia i służące do usuwania skażenia Jeżeli to możliwe i bezpieczne, zlikwidować lub ograniczyć wyciek (uszczelnić, zamknąć dopływ cieczy, uszkodzone opakowanie umieścić w opakowaniu awaryjnym). Ograniczyć rozprzestrzenianie się rozlewiska przez obwałowanie terenu; zebrane duże ilości cieczy odpompować. Małe ilości rozlanej cieczy przysypać niepalnym materiałem chłonnym (ziemia, piasek oraz materiałami neutralizującymi kwasy, np. węglanem wapnia lub sodu, zmielonym wapieniem, dolomitem), zebrać do zamykanego pojemnika i przekazać do zniszczenia. Zanieczyszczoną powierzchnię spłukać wodą. Popłuczyny zebrać i usunąć jako odpad niebezpieczny. |
Zawarty fragment instrukcji odnosi się do
Po dodaniu do kolby Kjeldahla próbki analizowanego materiału, kwasu siarkowego(VI) oraz katalizatora, należy delikatnie ogrzewać zawartość kolby za pomocą palnika gazowego. W początkowym etapie ogrzewania zawartość kolby wykazuje pienienie i zmienia kolor na ciemniejszy. W tym czasie należy przeprowadzać ogrzewanie bardzo ostrożnie, a nawet z przerwami, aby uniknąć "wydostania się" czarnobrunatnej masy do szyjki kolby.
Aby rozpuścić próbkę tłuszczu o wadze 5 g, wykorzystuje się 50 cm3 mieszanki 96% alkoholu etylowego oraz eteru dietylowego, połączonych w proporcji objętościowej 1 : 2. Jakie ilości cm3 każdego ze składników są potrzebne do przygotowania 150 cm3 tej mieszanki?
Jakie jest stężenie roztworu HNO3, który powstał w wyniku połączenia 50 cm3 roztworu HNO3 o stężeniu 0,2 mol/dm3 oraz 25 cm3 roztworu HNO3 o stężeniu 0,5 mol/dm3?
Jakie urządzenie laboratoryjne jest używane do realizacji procesu ekstrakcji?
Podczas analizowania zmienności składu wód płynących w skali rocznej, próbki wody powinny być zbierane i badane przynajmniej raz na
Próbkę wody przeznaczoną do oznaczenia zawartości metali poddaje się utrwalaniu za pomocą
| Sposoby utrwalania i przechowywania próbek wody przeznaczonych do badań fizykochemicznych. | |
|---|---|
| Oznaczenie | Sposób utrwalania i przechowywania |
| Barwa | Przechowywać w ciemności |
| Mętność | Przechowywać w ciemności |
| Twardość | pH = 3 z użyciem HNO₃ |
| OWO | 0,7 ml HCl/30 ml próbki |
| ChZT | pH 1-2 z użyciem H₂SO₄ |
| Fosfor | Przechowywać w temperaturze 1-5°C |
| Glin | pH 1-2 z użyciem HNO₃ |
| Żelazo | pH 1-2 z użyciem HNO₃ |
| Utlenialność | pH1-2 z użyciem H₂SO₄. Przechowywać w ciemności |
Próbka, którą analizujemy, to bardzo rozcieńczony wodny roztwór soli nieorganicznych, który ma być poddany analizie. Proces, który można zastosować do zagęszczenia tego roztworu, to
W trakcie korzystania z odczynnika opisanego na etykiecie, należy szczególnie zwrócić uwagę na zagrożenia związane
Który sposób przechowywania próbek żywności jest niezgodny z Rozporządzeniem Ministra Zdrowia?
| Fragment Rozporządzenia Ministra Zdrowia w sprawie pobierania i przechowywania próbek żywności przez zakłady żywienia zbiorowego typu zamkniętego |
| (...) Zakład przechowuje próbki, przez co najmniej 3 dni, licząc od chwili, kiedy cała partia została spożyta w miejscu wyłącznym właściwym do tego celu oraz w warunkach zapewniających utrzymanie temperatury +4°C lub niższej, w zależności od przechowywanego produktu. Miejsce przechowywania próbek musi być tak zabezpieczone, aby dostęp do niego posiadał tylko kierujący zakładem lub osoba przez niego upoważniona. |
Substancje kancerogenne to
Ile wynosi objętość roztworu o stężeniu 0,5 mol/dm3, jeśli przygotowano go z 0,1 mola KOH?
Proces oddzielania składników jednorodnej mieszaniny, polegający na eliminacji jednego lub większej ilości składników z roztworu lub substancji stałej przy użyciu odpowiednio wybranego rozpuszczalnika, to