Pytanie 1
Reagent, który reaguje wyłącznie z jednym konkretnym jonem lub związkiem, nazywamy reagente
Wynik: 24/40 punktów (60,0%)
Wymagane minimum: 20 punktów (50%)
Reagent, który reaguje wyłącznie z jednym konkretnym jonem lub związkiem, nazywamy reagente
Jakie urządzenie służy do pomiaru temperatury topnienia substancji chemicznych?
W jakiej standardowej temperaturze są kalibrowane szklane naczynia pomiarowe?
Jak przebiega procedura unieszkodliwiania rozlanego kwasu siarkowego(VI)?
Do kolby destylacyjnej wprowadzono 200 cm3 zanieczyszczonego acetonu o gęstości d = 0,9604 g/cm3 oraz czystości 90% masowych. W celu oczyszczenia przeprowadzono proces destylacji, w wyniku czego uzyskano 113,74 g czystego acetonu. Jakie były straty acetonu podczas destylacji?
Połączono równe ilości cynku i bromu, a następnie poddano je reakcji Zn + Br2 → ZnBr2. W tych warunkach stopień reakcji cynku wynosi (masy atomowe: Zn – 65u, Br – 80u)?
Butle gazowe (czasy butli) napełnione wodorem są oznaczone kolorem
Odpady, które w przeważającej mierze składają się z osadów siarczków metali ciężkich, nazywa się
Roztwór, który jest dodawany z biurety w formie kropli do roztworu substancji, którą analizujemy, określamy mianem
Czego brakuje w zestawie pokazanym na ilustracji?
Jaką masę siarczanu(VI) miedzi(II)-woda(1/5) należy poddać suszeniu, aby otrzymać 300 g soli bezwodnej?
| CuSO4 · 5H2O → CuSO4 + 5H2O |
| (MCuSO4·5H2O = 249,5 g/mol, MCuSO4 = 159,5 g/mol, MH2O = 18,0 g/mol) |
Woda, która została poddana dwukrotnej destylacji, to woda
Jakie procedury powinny być stosowane podczas ustalania miana roztworu?
Roztwór o dokładnej masie z odważki analitycznej powinien być sporządzony
Jakie urządzenie jest wykorzystywane do oczyszczania próbki gazowej?
Etykiety chemikaliów zawierają zwroty H, które informują o rodzaju zagrożenia. Cyfra "3" pojawiająca się po literze "H" w oznaczeniu, definiuje rodzaj zagrożenia?
Podczas rozkładu chloranu(V) potasu powstają chlorek potasu oraz tlen. Ile gramów tlenu zostanie wydzielonych w trakcie rozkładu 24,5 g chloranu(V) potasu, jeśli jednocześnie uzyskano 14,9 g chlorku potasu? Masy molowe pierwiastków: K = 39 g/mol, Cl = 35,5 g/mol, O=16 g/mol?
Fosfor biały, z uwagi na swoje właściwości, powinien być przechowywany
Proces wydobywania składnika z cieczy lub ciała stałego w mieszance wieloskładnikowej poprzez jego rozpuszczenie w odpowiednim rozpuszczalniku to
Nie należy używać gorącej wody do mycia
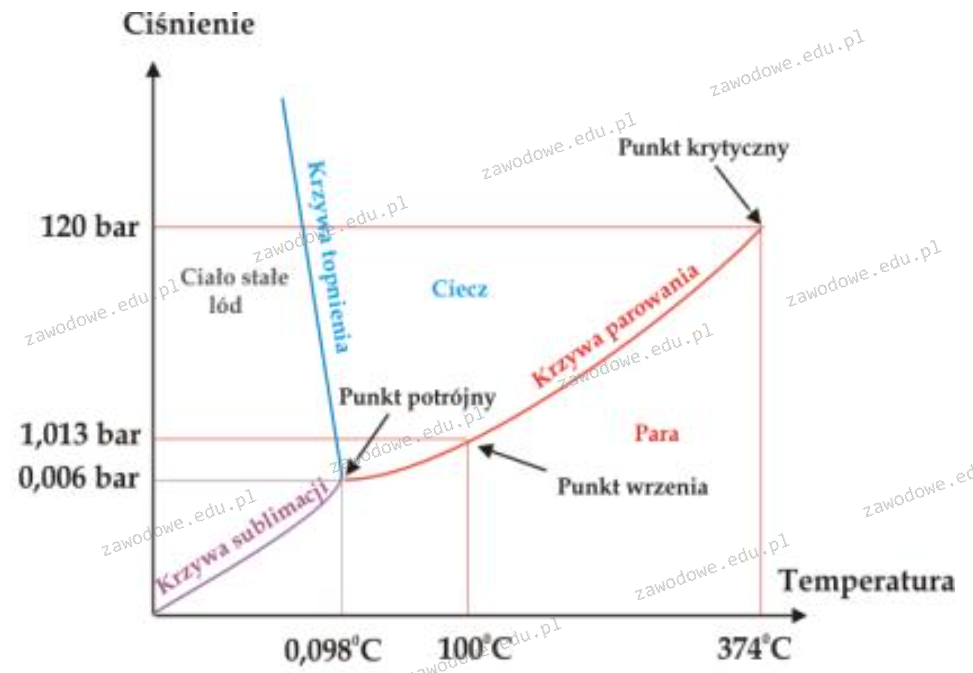
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Waga przedstawiona na rysunku umożliwia ważenie substancji z dokładnością do

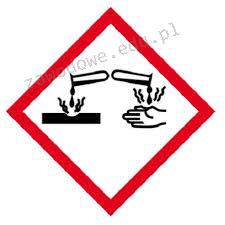
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
W karcie charakterystyki chemikaliów znajduje się informacja o przechowywaniu dichromianu(VI) potasu: .. powinien być przechowywany w odpowiednio oznakowanych, szczelnie zamkniętych pojemnikach, w chłodnym, suchym i dobrze wentylowanym magazynie, który posiada instalację elektryczną i wentylacyjną. Z tego opisu wynika, że ten chemikal może być przechowywany
Próbkę laboratoryjną dzieli się na dwie części, ponieważ
Z partii materiału należy pobrać ogólną próbkę w ilości odpowiadającej promilowi całej partii. Na podstawie podanej informacji określ, ile pierwotnych próbek, każda ważąca 10 g, trzeba pobrać z partii cukru o masie 0,5 t, aby uzyskać reprezentatywną próbkę ogólną?
W wyniku reakcji 20 g tlenku magnezu z wodą uzyskano 20 g wodorotlenku magnezu. Oblicz efektywność reakcji.
MMg = 24 g/mol, MO = 16 g/mol, MH = 1 g/mol?
Jakie jest stężenie molowe kwasu siarkowego(VI) o zawartości 96% i gęstości 1,84 g/cm3?
Intensywna reakcja z FeCl3 jest wykorzystywana do identyfikacji
Aby przyspieszyć reakcję, należy zwiększyć stężenie substratów
Jakiego odczynnika chemicznego, oprócz Na2Cr2O7, należy użyć do sporządzenia mieszaniny chromowej do czyszczenia sprzętu szklarskiego w laboratorium?
Podczas pobierania skoncentrowanego roztworu kwasu solnego konieczne jest pracowanie w włączonym dygestorium oraz zastosowanie
Aby przygotować miano kwasu solnego, konieczne jest odważenie węglanu sodu o masie wynoszącej około 400 mg. Jaką precyzję powinna mieć waga używana do odważenia węglanu sodu?
Aby przygotować zestaw do filtracji, należy zebrać
W trakcie kalibracji stężenia roztworu kwasu solnego na przynajmniej przygotowany roztwór zasady sodowej ma miejsce reakcja
Etykieta roztworu kwasu azotowego(V) o koncentracji 6 mol/dm3 powinna zawierać nazwę substancji oraz
Jakie urządzenie wykorzystuje się do pobierania próbek gazów?
Aby poprawić efektywność reakcji opisanej równaniem: HCOOH + C2H5OH ⇄ HCOOC2H5 + H2O, należy
Który z wskaźników nie jest używany w alkacymetrii?
Podczas oznaczania kwasu siarkowego zachodzi reakcja:
H2SO4 + 2NaOH → Na2SO4 + 2H2OZgodnie z zamieszczoną instrukcją, roztwór poreakcyjny należy
| Fragmenty instrukcji zbierania, utylizacji i eliminacji odpadów chemicznych | |
|---|---|
| Lista substancji, które mogą być usunięte z odpadami komunalnymi w postaci stałej, lub wprowadzone do systemu kanalizacyjnego w postaci rozcieńczonych roztworów wodnych, o ile ich ilość nie przekracza jednorazowo 100 g. | |
| Związki nieorganiczne Siarczany sodu, potasu, magnezu, wapnia, amonu | |
| Kwasy nieorganiczne Stężone kwasy ostrożnie rozcieńczyć przez wkroplenie z równoczesnym mieszaniem do wody z lodem, a następnie zneutralizować roztworem wodorotlenku sodowego. Po neutralizacji doprowadzić pH roztworu do zakresu 6-8 przelać do pojemnika S. Małe ilości kwasów takich jak siarkowy, solny, azotowy czy fosforowy (nie więcej niż 10 g) po rozcieńczeniu wodą i neutralizacji roztworem wodorotlenku sodowego oraz doprowadzeniu pH takiego roztworu do zakresu 6-8 można wylać do zlewu i obficie spłukać wodą. | |
| Sole nieorganiczne Stałe sole nieorganiczne – pojemnik N. Obojętne roztwory soli nieorganicznych pojemnik S. Sole metali ciężkich, sole o właściwościach toksycznych – pojemnik TN. |