Pytanie 1
Odważka analityczna przygotowana w fabryce zawiera 0,1 mola EDTA. Posiadając taką jedną odważkę analityczną, jakie roztwory można przygotować?
Wynik: 39/40 punktów (97,5%)
Wymagane minimum: 20 punktów (50%)
Odważka analityczna przygotowana w fabryce zawiera 0,1 mola EDTA. Posiadając taką jedną odważkę analityczną, jakie roztwory można przygotować?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Resztki szkła, osadników czy inne odpady stałe powstałe w laboratorium analitycznym powinny być umieszczone
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wapno palone uzyskuje się poprzez prażenie wapienia według równania: CaCO3 → CaO + CO2. Ile kilogramów wapienia należy zastosować, aby w efekcie jego prażenia otrzymać 7 kg wapna palonego, jeśli wydajność reakcji wynosi 50%?
Masy molowe: MCa = 40 g/mol, MC = 12 g/mol, MO = 16 g/mol.
Skuteczny środek do osuszania
Jakie środki stosuje się do czyszczenia szkła miarowego, które zostało zanieczyszczone substancjami tłustymi?
Na podstawie danych w tabeli określ, dla oznaczania którego parametru zalecaną metodą jest chromatografia jonowa.
| Parametr | Metoda podstawowa |
|---|---|
| pH | metoda potencjometryczna, kalibracja przy zastosowaniu minimum dwóch wzorców o pH zależnym od wartości oczekiwanych w próbkach wody |
| azotany(V) | chromatografia jonowa |
| fosforany(V) | spektrofotometria |
| Na, K, Ca, Mg | AAS (spektrometria absorpcji atomowej) |
| zasadowość | miareczkowanie wobec fenoloftaleiny oraz oranżu metylowego |
| tlen rozpuszczony, BZT₅ | metoda potencjometryczna |
Urządzeniem pomiarowym nie jest
Dekantacja to metoda
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Piktogram ukazujący czaszkę oraz skrzyżowane kości piszczelowe jest typowy dla substancji o działaniu
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Etykieta roztworu kwasu azotowego(V) o koncentracji 6 mol/dm3 powinna zawierać nazwę substancji oraz
Na podstawie informacji zawartych w tabeli wskaż mieszaninę oziębiającą o temperaturze -21 °C.
| Temperatura mieszaniny | Skład mieszaniny | Stosunek masowy |
| -15 °C | lód + octan sodu | 10:9 |
| -18 °C | lód + chlorek amonu | 10:3 |
| -21 °C | lód + chlorek sodu | 3:1 |
| -25 °C | lód + azotan amonu | 1:9 |
Fosfor biały, z uwagi na swoje właściwości, powinien być przechowywany
Oblicz masę wapienia, który został rozłożony, jeśli w trakcie reakcji uzyskano 44,8 dm3 CO2 (w warunkach standardowych).
MC = 12 g/mol, MCa = 40 g/mol, MO = 16 g/mol
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W urządzeniu Soxhleta wykonuje się
Naczynia miarowe o kształcie rurek poszerzonych w środku, z wąskim i wydłużonym dolnym końcem, przeznaczone do pobierania i transportowania cieczy o ściśle określonej objętości, to
Aby przygotować 250 cm3 0,2-molowego roztworu wodorotlenku sodu, należy odważyć
| MNaOH = 40g / mol |
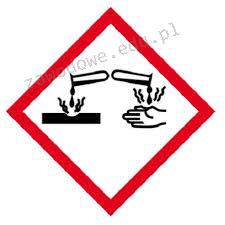
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Instalacja, do której należy podłączyć palnik, powinna być pokryta farbą w kolorze
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie pH ma roztwór buforowy otrzymany w wyniku zmieszania 0,2 M roztworu kwasu octowego i 0,2 M roztworu octanu sodu, w stosunku objętościowym 3 : 2?
| Bufor octanowy według Walpole'a | ||
|---|---|---|
| 0,2 M kwas octowy [ml] | 0,2 M octan sodu [ml] | pH |
| 7,0 | 3,0 | 4,39 |
| 6,0 | 4,0 | 4,58 |
| 5,0 | 5,0 | 4,75 |
| 4,0 | 6,0 | 4,94 |
| 3,0 | 7,0 | 5,13 |
W parownicy porcelanowej, w której znajduje się 2,5 g naftalenu, umieść krążek bibuły z niewielkimi otworami oraz odwrócony lejek szklany. Zatyczkę lejka zrób z korka z waty. Parownicę umieść w płaszczu grzejnym. Po delikatnym ogrzaniu parownicy, pary substancji przechodzą przez otwory w bibule i kondensują na wewnętrznych ściankach lejka... Powyższy opis dotyczy metody oczyszczania naftalenu przez
Skalę wzorców do oznaczenia barwy przygotowano w cylindrach Nesslera o pojemności 100 cm3. Barwa oznaczona w tabeli jako X wynosi
| Skala wzorców do barwy | ||||
|---|---|---|---|---|
| Ilość wzorcowego roztworu podstawowego cm3 (c=500 mg Pt/dm3) | 0 | 1,0 | 2,0 | 3,0 |
| Barwa w stopniach mg Pt/dm3 | 0 | 5 | X | 15 |
Próbka wzorcowa to próbka
Zestaw do filtracji nie zawiera
Oddzielanie płynnej mieszaniny wieloskładnikowej poprzez odparowanie, a następnie skraplanie jej komponentów, to proces
Aby otrzymać 200 g roztworu siarczanu(VI) sodu o stężeniu 12%, należy wykorzystać
(Na – 23 g/mol; S – 32 g/mol; H – 1 g/mol; O – 16 g/mol)
Czy odpady laboratoryjne zawierające jony metali ciężkich powinny zostać poddane obróbce przed umieszczeniem ich w odpowiednio oznaczonej pojemności?
Wskaż zbiór substancji, które po rozpuszczeniu w wodzie stają się elektrolitami?
Reagent, który reaguje wyłącznie z jednym konkretnym jonem lub związkiem, nazywamy reagente
Z przedstawionego opisu wynika, że kluczową właściwością próbki analitycznej jest jej
Próbka analityczna to fragment materiału stworzony z myślą o przeprowadzeniu badania lub obserwacji. Powinna odzwierciedlać przeciętny skład i cechy materiału, który jest badany.
Odpady, które w przeważającej mierze składają się z osadów siarczków metali ciężkich, nazywa się
Którą substancję można bezpośrednio wyrzucić do odpadów komunalnych?
Aby uzyskać roztwór AgNO3 (masa molowa AgNO3 to 169,8 g/mol) o stężeniu 0,1 mol/dm3, należy rozpuścić w wodzie destylowanej i dopełnić kolbę wodą destylowaną do zaznaczonej kreski.
Ile wynosi objętość roztworu o stężeniu 0,5 mol/dm3, jeśli przygotowano go z 0,1 mola KOH?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.