Pytanie 1
Do szklanych narzędzi laboratoryjnych wielomiarowych używanych w analizach ilościowych należy
Wynik: 27/40 punktów (67,5%)
Wymagane minimum: 20 punktów (50%)
Do szklanych narzędzi laboratoryjnych wielomiarowych używanych w analizach ilościowych należy
W standardowym układzie destylacyjnym, który ma ukośną chłodnicę, wykorzystuje się chłodnicę
Aby przygotować 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3, jaką kolbę miarową o pojemności należy wykorzystać?
Etykiety chemikaliów zawierają zwroty H, które informują o rodzaju zagrożenia. Cyfra "3" pojawiająca się po literze "H" w oznaczeniu, definiuje rodzaj zagrożenia?
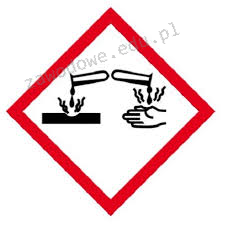
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
Naczynia miarowe o kształcie rurek poszerzonych w środku, z wąskim i wydłużonym dolnym końcem, przeznaczone do pobierania i transportowania cieczy o ściśle określonej objętości, to
Symbol "In" znajduje się na
Do filtracji osadów drobnokrystalicznych wykorzystuje się filtry
Czułość bezwzględna wagi definiuje się jako
Reagenty o najwyższej czystości to reagenty
Aby uzyskać drobnokrystaliczny osad BaSO4, należy wykonać poniższe kroki:
Do zlewki wlać 20 cm3 roztworu BaCl2, następnie dodać 100 cm3 wody destylowanej oraz kilka kropli roztworu HCl. Zawartość zlewki podgrzać na łaźni wodnej, a potem, ciągle mieszając, dodać 35 cm3 roztworu H2SO4.
Mieszaninę ogrzewać na łaźni wodnej przez 1 godzinę. Osad odsączyć i przepłukać kilkakrotnie gorącą wodą zakwaszoną kilkoma kroplami roztworu H2SO4.
Według przedstawionej procedury, do uzyskania osadu BaSO4 potrzebne są:
W parownicy porcelanowej, w której znajduje się 2,5 g naftalenu, umieść krążek bibuły z niewielkimi otworami oraz odwrócony lejek szklany. Zatyczkę lejka zrób z korka z waty. Parownicę umieść w płaszczu grzejnym. Po delikatnym ogrzaniu parownicy, pary substancji przechodzą przez otwory w bibule i kondensują na wewnętrznych ściankach lejka... Powyższy opis dotyczy metody oczyszczania naftalenu przez
Jaką objętość powinna mieć kolba miarowa, aby przygotować mianowany roztwór NaOH o stężeniu 0,050 M z analitycznej odważki, która zawiera 0,1 mola NaOH?
Odważka analityczna przygotowana w fabryce zawiera 0,1 mola EDTA. Posiadając taką jedną odważkę analityczną, jakie roztwory można przygotować?
Proces usuwania substancji z cieczy lub wydobywania składnika z mieszanin cieczy, oparty na równowadze fazowej ciecz-gaz, nazywa się
Jakiego odczynnika chemicznego, oprócz Na2Cr2O7, należy użyć do sporządzenia mieszaniny chromowej do czyszczenia sprzętu szklarskiego w laboratorium?
Jaką objętość roztworu NaOH o stężeniu 1 mol/dm3 należy użyć, aby przygotować 50 cm3 roztworu NaOH o stężeniu 0,4 mol/dm3?
Aby obliczyć gęstość cieczy przy użyciu metody hydrostatycznej, należy zastosować
Aby wykonać czynności analityczne wskazane w ramce, należy użyć:
| Otrzymaną do badań próbkę badanego roztworu rozcieńczyć wodą destylowaną w kolbie miarowej o pojemności 100 cm3 do kreski i dokładnie wymieszać. Następnie przenieść pipetą 10 cm3 tego roztworu do kolby stożkowej, dodać ok. 50 cm3 wody destylowanej. |
Połączono równe ilości cynku i bromu, a następnie poddano je reakcji Zn + Br2 → ZnBr2. W tych warunkach stopień reakcji cynku wynosi (masy atomowe: Zn – 65u, Br – 80u)?
Jakie urządzenie służy do pomiaru temperatury topnienia substancji chemicznych?
W trakcie destylacji cieczy wykorzystuje się tzw. kamienie wrzenne, ponieważ
Na diagramie przedstawiającym proces pobierania prób środowiskowych do analizy literą Y oznaczono próbkę
Wodę do badań mikrobiologicznych powinno się pobierać do butelek
Która z metod pozwala na oddzielanie składników mieszaniny na podstawie różnic w ich zachowaniu w układzie składającym się z dwóch faz, z których jedna jest fazą stacjonarną, a druga porusza się w określonym kierunku względem niej?
Odlanie cieczy z nad osadu to
Czy odpady laboratoryjne zawierające jony metali ciężkich powinny zostać poddane obróbce przed umieszczeniem ich w odpowiednio oznaczonej pojemności?
Dokonano pomiaru pH dwóch roztworów, uzyskując wartości pH= 2 oraz pH= 5. Wskaźnij poprawnie sformułowany wniosek.
Podczas reakcji chlorku żelaza(III) z wodorotlenkiem potasu dochodzi do wytrącenia wodorotlenku żelaza(III) w formie
Co oznacza zapis cz.d.a. na etykiecie opakowania odczynnika chemicznego?
W celu rozdrabniania niewielkich ilości bardzo twardego materiału wykorzystuje się moździerze
Jakie jest stężenie molowe roztworu, jeśli w 100 cm3 roztworu znajduje się 5,6 g KOH?
MK = 39 g/mol, MO = 16 g/mol, MH = 1 g/mol
Jakie procesy towarzyszy efekt egzotermiczny?
Między wodorotlenkiem baru a chlorkiem amonu dochodzi do spontanicznej reakcji, która powoduje silne schłodzenie mieszaniny oraz wydobycie się charakterystycznego zapachu amoniaku.
Ba(OH)2(s) + 2 NH4Cl(s) → BaCl2(aq) + 2 H2O(c) + 2 NH3(g) Wskaź, które sformułowanie właściwie wyjaśnia to zjawisko.
nieodwracalnie jej równowagę.
W tabeli przestawiono dane dotyczące wybranych roztworów wodnych wodorotlenku sodu.
Oblicz masę wodorotlenku sodu, jaką należy rozpuścić w 200,0 cm3 wody, aby otrzymać roztwór o gęstości 1,0428 g/cm3.
| d420 [g/cm3] | masa NaOH [g/100 cm3] |
|---|---|
| 1,0095 | 1,01 |
| 1,0207 | 2,04 |
| 1,0428 | 4,17 |
| 1,0648 | 6,39 |
| 1,0869 | 8,70 |
| 1,1089 | 11,09 |
Jaką substancję należy koniecznie oddać do utylizacji?
Technika kwartowania (ćwiartkowania) pozwala na redukcję masy próbki ogólnej
Próbkę wody przeznaczoną do oznaczenia zawartości metali poddaje się utrwalaniu za pomocą
| Sposoby utrwalania i przechowywania próbek wody przeznaczonych do badań fizykochemicznych. | |
|---|---|
| Oznaczenie | Sposób utrwalania i przechowywania |
| Barwa | Przechowywać w ciemności |
| Mętność | Przechowywać w ciemności |
| Twardość | pH = 3 z użyciem HNO₃ |
| OWO | 0,7 ml HCl/30 ml próbki |
| ChZT | pH 1-2 z użyciem H₂SO₄ |
| Fosfor | Przechowywać w temperaturze 1-5°C |
| Glin | pH 1-2 z użyciem HNO₃ |
| Żelazo | pH 1-2 z użyciem HNO₃ |
| Utlenialność | pH1-2 z użyciem H₂SO₄. Przechowywać w ciemności |
Aby sporządzić 20 cm3 roztworu HCl (1+1), należy w pierwszej kolejności wlać do zlewki
Piktogram ukazujący czaszkę oraz skrzyżowane kości piszczelowe jest typowy dla substancji o działaniu