Pytanie 1
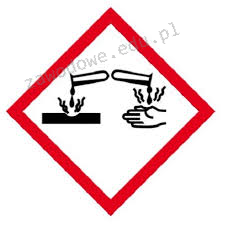
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
Wynik: 24/40 punktów (60,0%)
Wymagane minimum: 20 punktów (50%)
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?

Z próbki zawierającej siarczany(VI) należy najpierw wydzielić metodą filtracji zanieczyszczenia, które są nierozpuszczalne w wodzie. Dokładność wypłukania tych zanieczyszczeń weryfikuje się za pomocą roztworu
Podczas pobierania próby wody do oznaczania metali ciężkich zaleca się stosowanie butelek wykonanych z:
Naczynia miarowe, skalibrowane "na wlew" (IN) to:
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby uniknąć trwałego połączenia szlifowanych części sprzętu laboratoryjnego, co należy zrobić?
Aby poprawić efektywność reakcji opisanej równaniem: HCOOH + C2H5OH ⇄ HCOOC2H5 + H2O, należy
Podstawowy zestaw do filtracji, oprócz statywu i sączka, obejmuje
Wybierz poprawny zapis jonowy spośród podanych reakcji, w których otrzymywany jest siarczan(VI) baru.
Aby przygotować 250 cm3 0,2-molowego roztworu wodorotlenku sodu, należy odważyć
| MNaOH = 40g / mol |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie jest stężenie molowe kwasu siarkowego(VI) o zawartości 96% i gęstości 1,84 g/cm3?
Jakie jest stężenie procentowe roztworu HCl (M=36,46 g/mol) o gęstości 1,19 g/cm3 oraz stężeniu molowym 12 mol/dm3?
Gęstość próbki cieczy wyznacza się przy użyciu
Ile węglanu sodu trzeba odmierzyć, aby uzyskać 200 cm3 roztworu o stężeniu 8% (m/v)?
Mianowanie roztworu o stężeniu przybliżonym można wykonać poprzez
Rozpuszczalnik stosowany w procesie krystalizacji powinien
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Z podanego wykazu wybierz sprzęt potrzebny do zmontowania zestawu do sączenia pod próżnią.
| 1 | 2 | 3 | 4 | 5 | 6 |
| pompka wodna | lejek z długą nóżką | kolba okrągłodenna | kolba ssawkowa | lejek sitowy | chłodnica powietrzna |
Jaką objętość powinna mieć kolba miarowa, aby przygotować mianowany roztwór NaOH o stężeniu 0,050 M z analitycznej odważki, która zawiera 0,1 mola NaOH?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Pierwotna próbka jest zbierana
Który sposób przechowywania próbek żywności jest niezgodny z Rozporządzeniem Ministra Zdrowia?
| Fragment Rozporządzenia Ministra Zdrowia w sprawie pobierania i przechowywania próbek żywności przez zakłady żywienia zbiorowego typu zamkniętego |
| (...) Zakład przechowuje próbki, przez co najmniej 3 dni, licząc od chwili, kiedy cała partia została spożyta w miejscu wyłącznym właściwym do tego celu oraz w warunkach zapewniających utrzymanie temperatury +4°C lub niższej, w zależności od przechowywanego produktu. Miejsce przechowywania próbek musi być tak zabezpieczone, aby dostęp do niego posiadał tylko kierujący zakładem lub osoba przez niego upoważniona. |
W laboratorium chemicznym systemy wodne zazwyczaj oznacza się kolorem zielonym
Jakim przyrządem nie jest możliwe określenie gęstości cieczy?
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
Aby przeprowadzić analizę jakościową, próbkę mosiądzu należy roztworzyć w stężonym kwasie
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Reagent, który reaguje wyłącznie z jednym konkretnym jonem lub związkiem, nazywamy reagente
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Oddzielanie płynnej mieszaniny wieloskładnikowej poprzez odparowanie, a następnie skraplanie jej komponentów, to proces
Aby zebrać próbki gazów, wykorzystuje się
Jakie urządzenie służy do pomiaru temperatury topnienia substancji chemicznych?
Po połączeniu 50 cm3 wody z 50 cm3 alkoholu etylowego, objętość otrzymanej mieszanki jest poniżej 100 cm3. Zjawisko to jest spowodowane
W nieopisanej butelce prawdopodobnie znajduje się roztwór zasadowy. Wskaż odczynnik, który pozwoli to zweryfikować?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Która część małej partii materiału jest najczęściej pobierana w celu przygotowania próbki ogólnej?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Podczas rozkładu chloranu(V) potasu powstają chlorek potasu oraz tlen. Ile gramów tlenu zostanie wydzielonych w trakcie rozkładu 24,5 g chloranu(V) potasu, jeśli jednocześnie uzyskano 14,9 g chlorku potasu? Masy molowe pierwiastków: K = 39 g/mol, Cl = 35,5 g/mol, O=16 g/mol?