Pytanie 1
Do przechowywania stężonego kwasu azotowego(V) w laboratorium należy stosować:
Wynik: 23/40 punktów (57,5%)
Wymagane minimum: 20 punktów (50%)
Do przechowywania stężonego kwasu azotowego(V) w laboratorium należy stosować:
Na podstawie zamieszczonych w tabeli opisów metod rozdzielania mieszanin, dobierz odpowiadające im nazwy.
| Tabela. Metody rozdzielania mieszanin | |
|---|---|
| Lp. | Opis metody |
| I. | Zlewanie cieczy znad osadu. |
| II. | Przeprowadzenie ciekłego rozpuszczalnika w stan pary. |
| III. | Wyodrębnianie z mieszaniny ciał stałych lub cieczy składnika przy pomocy rozpuszczalnika tak dobranego, aby rozpuszczał żądany związek chemiczny. |
| IV. | Powolne opadanie cząstek substancji stałej w cieczy pod wpływem własnego ciężaru. |
Na etykiecie odważki analitycznej znajduje się napis: Z odważki tej można przygotować
Odważka analityczna azotan(V) srebra(I) AgNO3 0,1 mol/dm3 |
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
W tabeli zamieszczono temperatury wrzenia niektórych składników powietrza. Na podstawie tych danych podaj, który ze składników oddestyluje jako ostatni.
| Temperatura wrzenia °C | Składniki |
|---|---|
| -245,9 | Neon |
| -182,96 | Tlen |
| -195,8 | Azot |
| -185,7 | Argon |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie urządzenie jest wykorzystywane do oczyszczania próbki gazowej?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Metodą, która nie służy do utrwalania próbek wody, jest
Co oznacza skrót AKT?
Wskaż, do jakiego typu należą zamieszczone równania reakcji.
| I. 2 Mg + O2 → 2 MgO |
| II. 2 KMnO4 → K2MnO4 + MnO2 + O2 |
| III. BaCl2 + H2SO4→ BaSO4 + 2 HCl |
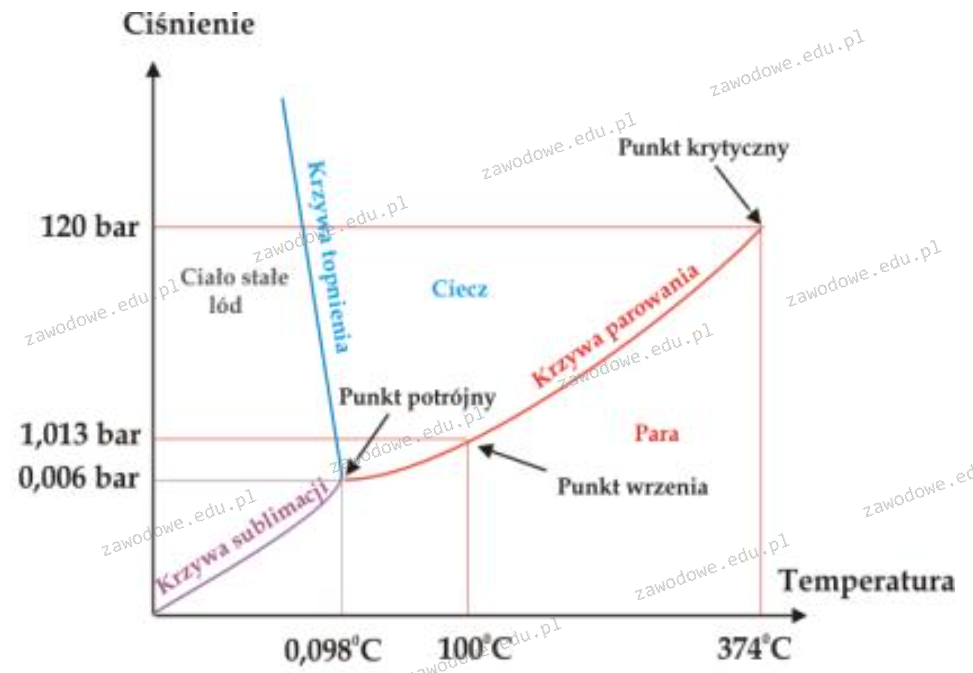
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Aby uzyskać sole sodowe fenoli, należy stopić dany fenol z sodą (M = 106 g/mol), stosując 10% nadmiar w porównaniu do ilości stechiometrycznej, według równania:
2 ArOH + Na2CO3 → 2 ArONa + H2O + CO2 Ile sody jest wymagane do reakcji z 7,2 g 2-naftolu (M = 144 g/mol)?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Podczas przygotowywania roztworów buforowych do analizy pH w laboratorium istotne jest, aby:
Aby odcedzić galaretowaty osad, konieczne jest użycie sączka
Odczynnik chemiczny, w którym zawartość domieszek wynosi od 1 do 10%, jest nazywany odczynnikiem
Jaką objętość roztworu NaOH o stężeniu 1 mol/dm3 należy użyć, aby przygotować 50 cm3 roztworu NaOH o stężeniu 0,4 mol/dm3?
Z 250 g benzenu (M = 78 g/mol) uzyskano 350 g nitrobenzenu (M = 123 g/mol). Jaka jest wydajność reakcji nitrowania?
Określ, jakie informacje powinny być zarejestrowane w ewidencji wydania substancji niebezpiecznych, stosowanych w badaniach laboratoryjnych?
Ile węglanu sodu trzeba odmierzyć, aby uzyskać 200 cm3 roztworu o stężeniu 8% (m/v)?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Na podstawie informacji zawartych w tabeli wskaż mieszaninę oziębiającą o temperaturze -21 °C.
| Temperatura mieszaniny | Skład mieszaniny | Stosunek masowy |
| -15 °C | lód + octan sodu | 10:9 |
| -18 °C | lód + chlorek amonu | 10:3 |
| -21 °C | lód + chlorek sodu | 3:1 |
| -25 °C | lód + azotan amonu | 1:9 |
Do pojemników na odpady stałe, które są przeznaczone do utylizacji, nie można wprowadzać bezpośrednio cyjanków oraz związków kompleksowych zawierających jony cyjankowe z powodu
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do narzędzi pomiarowych zalicza się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jak nazywa się naczynie o płaskim dnie, które wykorzystuje się do pozyskiwania substancji stałej poprzez stopniowe odparowanie rozpuszczalnika z roztworu?
Substancje, które wykorzystuje się do ustalania miana roztworu, to
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do rozpuszczania próbek wykorzystuje się wodę królewską, która stanowi mieszaninę stężonych kwasów
Woda, która została poddana dwukrotnej destylacji, to woda
W celu przygotowania 100 cm3 roztworu mianowanego, jaką kolbę należy zastosować?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Na podstawie informacji zawartych w tabeli określ, który parametr spośród podanych należy oznaczyć w pierwszej kolejności.
| Tabela. Sposoby utrwalania próbek wody i ścieków, miejsce analizy, dopuszczalny czas przechowywania próbek | ||||
|---|---|---|---|---|
| Oznaczany parametr | Rodzaj naczynia do przechowywania próbki | Sposób utrwalania próbki | Miejsce wykonania analizy | Dopuszczalny czas przechowywania próbki |
| Chlorki | szklane lub polietylenowe | - | laboratorium | 96 godzin |
| Chlor pozostały | szklane | - | w miejscu pobrania próbki | - |
| ChZT | szklane | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 24 godziny |
| Kwasowość | szklane lub polietylenowe | schłodzenie do temperatury 2-5°C | laboratorium | 4 godziny |
| Mangan | szklane lub polietylenowe | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 48 godziny |
Podstawowy zestaw do filtracji, oprócz statywu i sączka, obejmuje