Pytanie 1
Jak przebiega procedura unieszkodliwiania rozlanego kwasu siarkowego(VI)?
Wynik: 40/40 punktów (100,0%)
Wymagane minimum: 20 punktów (50%)
Jak przebiega procedura unieszkodliwiania rozlanego kwasu siarkowego(VI)?
Analiza technicznego kwasu solnego dała następujące wyniki: 30% HCl, 0,008% H2SO4, 0,04% Fe.
Korzystając z zamieszczonej tabeli wymagań, określ gatunek kwasu, pamiętając, że decyduje o nim najgorszy wskaźnik.
| Wymagania chemiczne dotyczące kwasu siarkowego | ||||
| Wymagania | Gatunki | |||
| I | II | III | IV | |
| Chlorowodór, % | > 33 | > 29 | > 28 | > 27 |
| Kwas siarkowy(VI) w przel. na SO42-, % | < 0,009 | < 0,5 | < 1,6 | < 1,8 |
| Żelazo (Fe3+), % | < 0,005 | < 0,03 | < 0,03 | < 0,05 |
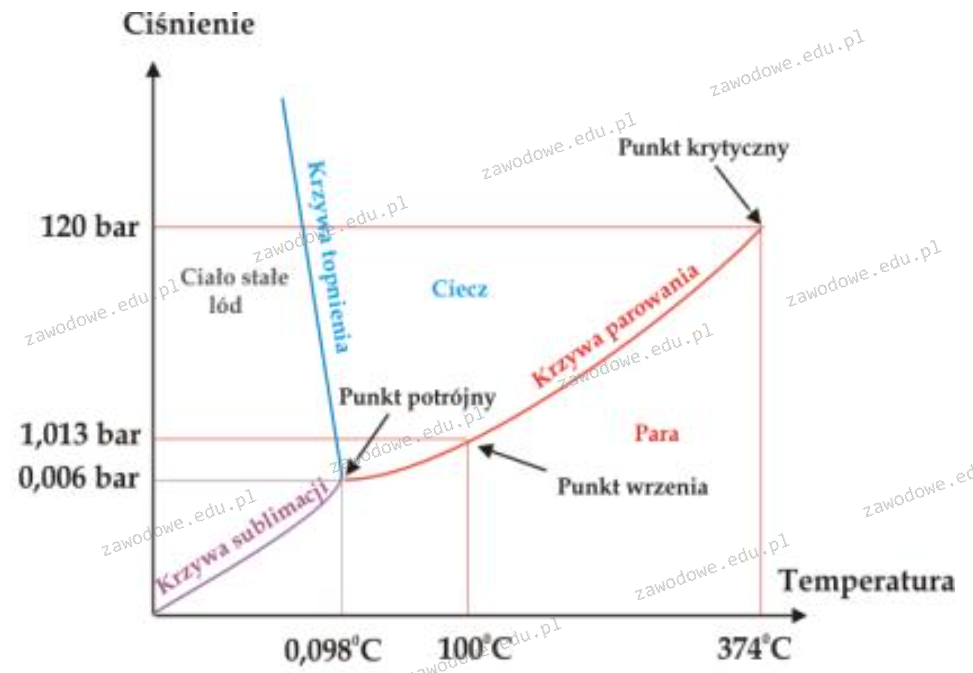
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Jakie procesy towarzyszy efekt egzotermiczny?
Aby uzyskać wodorotlenek wapnia, odważono 30 g węglanu wapnia, który następnie wyprażono. Powstały tlenek wapnia dodano do 100 cm3 wody, a otrzymany osad wysuszono i zważono, uzyskując 18,5 g wodorotlenku wapnia. Jaką wydajność miała ta reakcja?
Ca – 40 g/mol; O – 16 g/mol; C – 12 g/mol; H – 1 g/mol
Fragment procedury analitycznej
(...) Przenieś badany roztwór całkowicie do rozdzielacza gruszkowego o pojemności od 50 do 100 cm3, dodaj 5 cm3 roztworu tiocyjanianu potasu oraz 10 cm3 alkoholu izopentylowego, a następnie wstrząsaj zawartością przez 30 sekund.
Po rozdzieleniu faz przenieś roztwór wodny do drugiego rozdzielacza, natomiast fazę organiczną do suchej kolbki miarowej o pojemności 50 cm3(...) Który rodzaj ekstrakcji jest opisany w powyższym fragmencie?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie pH ma roztwór buforowy otrzymany w wyniku zmieszania 0,2 M roztworu kwasu octowego i 0,2 M roztworu octanu sodu, w stosunku objętościowym 3 : 2?
| Bufor octanowy według Walpole'a | ||
|---|---|---|
| 0,2 M kwas octowy [ml] | 0,2 M octan sodu [ml] | pH |
| 7,0 | 3,0 | 4,39 |
| 6,0 | 4,0 | 4,58 |
| 5,0 | 5,0 | 4,75 |
| 4,0 | 6,0 | 4,94 |
| 3,0 | 7,0 | 5,13 |
Technika oddzielania płynnych mieszanin, w której wykorzystuje się różnice w prędkości migracji składników przez odpowiednią bibułę, nazywa się
Jakie jest pH 0,001-molowego roztworu NaOH?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie urządzenie laboratoryjne jest używane do realizacji procesu ekstrakcji?
Ustalanie miana roztworu polega na
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Sączenie osadów kłaczkowatych odbywa się przy użyciu sączków
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Błąd związany z odczytem poziomu cieczy w kolbie miarowej, spowodowany niewłaściwą pozycją oka w stosunku do skali, nazywany jest błędem
Aby przygotować 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3, jaką kolbę miarową o pojemności należy wykorzystać?
Oblicz stężenie molowe 250 cm3 roztworu NaOH, w którym znajduje się 0,5 g substancji. Masa molowa NaOH wynosi 40 g/mol
Przebieg: Po zważeniu dwóch suchych zlewek, odważ kolejno: do jednej 3,63 g Co(NO3)2·6H2O, a do drugiej 3,75 g Na2CO3·10H2O. Następnie do obu zlewek wlej 25 cm3 gorącej wody i mieszając za pomocą bagietki doprowadź do całkowitego rozpuszczenia soli. Do roztworu Co(NO3)2 dodaj gorący roztwór Na2CO3 podczas mieszania. Otrzymany roztwór schłodź w łaźni wodnej z 3 kostkami lodu do temperatury pokojowej. Schłodzony roztwór przefiltruj przy użyciu zestawu do sączenia pod próżnią. Osad na lejku przepłucz wodą destylowaną, aż osiągnie obojętny odczyn przesączu. Przesączony osad osusz z sączkiem międzyposiadającym złożone arkusze bibuły w temperaturze pokojowej. Po wyschnięciu osad zważ i oblicz wydajność. Określ, jaki czynnik wpływa na skład jakościowy uzyskanego węglanu kobaltu(II)?
Która z metod pozwala na oddzielanie składników mieszaniny na podstawie różnic w ich zachowaniu w układzie składającym się z dwóch faz, z których jedna jest fazą stacjonarną, a druga porusza się w określonym kierunku względem niej?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do kolby destylacyjnej wprowadzono 200 cm3 zanieczyszczonego acetonu o gęstości d = 0,9604 g/cm3 oraz czystości 90% masowych. W celu oczyszczenia przeprowadzono proces destylacji, w wyniku czego uzyskano 113,74 g czystego acetonu. Jakie były straty acetonu podczas destylacji?
Zestaw do filtracji pod obniżonym ciśnieniem powinien obejmować między innymi
Aby przyspieszyć reakcję, należy zwiększyć stężenie substratów
Jakie jest znaczenie skrótu: cz. na etykiecie reagentu chemicznego?
Jaką masę NaCl uzyskuje się poprzez odparowanie do sucha 250 g roztworu 10%?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Część partii pobrana w sposób jednorazowy z jednego źródła towaru zapakowanego lub z jednego opakowania jednostkowego określana jest mianem próbki
Do filtracji osadów drobnokrystalicznych wykorzystuje się filtry
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Przedstawiono wyciąg z karty charakterystyki substancji chemicznej. Na podstawie informacji zawartej w zamieszczonym fragmencie karty wskaż wzór chemiczny substancji, której można użyć jako materiału neutralizującego lodowaty kwas octowy.
Kwas octowy lodowaty 99,5% Materiały zapobiegające rozprzestrzenianiu się skażenia i służące do usuwania skażenia Jeżeli to możliwe i bezpieczne, zlikwidować lub ograniczyć wyciek (uszczelnić, zamknąć dopływ cieczy, uszkodzone opakowanie umieścić w opakowaniu awaryjnym). Ograniczyć rozprzestrzenianie się rozlewiska przez obwałowanie terenu; zebrane duże ilości cieczy odpompować. Małe ilości rozlanej cieczy przysypać niepalnym materiałem chłonnym (ziemia, piasek oraz materiałami neutralizującymi kwasy, np. węglanem wapnia lub sodu, zmielonym wapieniem, dolomitem), zebrać do zamykanego pojemnika i przekazać do zniszczenia. Zanieczyszczoną powierzchnię spłukać wodą. Popłuczyny zebrać i usunąć jako odpad niebezpieczny. |
Losowo należy pobierać próbki z opakowań
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Reagenty o czystości na poziomie 99,999% — 99,9999% to reagenty
W trakcie określania miana roztworu NaOH, do zmiareczkowania 25,0 cm3 tego roztworu, użyto 30,0 cm3 roztworu HCl o stężeniu 0,1000 mol/dm3. Jakie miało miano zasady?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.