Pytanie 1
Jakie metody można zastosować do rozdzielania i koncentracji składników próbki?
Wynik: 0/40 punktów (0,0%)
Wymagane minimum: 20 punktów (50%)
Jakie metody można zastosować do rozdzielania i koncentracji składników próbki?
Podstawowa substancja w analizie miareczkowej charakteryzuje się następującymi właściwościami:
Która część małej partii materiału jest najczęściej pobierana w celu przygotowania próbki ogólnej?
Wskaż, do jakiego typu należą zamieszczone równania reakcji.
| I. 2 Mg + O2 → 2 MgO |
| II. 2 KMnO4 → K2MnO4 + MnO2 + O2 |
| III. BaCl2 + H2SO4→ BaSO4 + 2 HCl |
Jednym z sposobów oddzielania jednorodnych mieszanin jest
Wagi laboratoryjne można klasyfikować według nośności oraz precyzji na
Brak odpowiedzi na to pytanie.
Ogrzewanie organicznych substancji w atmosferze powietrza w otwartym naczyniu, mające na celu przemianę tych substancji w związki nieorganiczne, określa się jako mineralizacja?
Brak odpowiedzi na to pytanie.
Ogólna próbka, jednostkowa lub pierwotna powinna
Brak odpowiedzi na to pytanie.
Jak przebiega procedura unieszkodliwiania rozlanego kwasu siarkowego(VI)?
Brak odpowiedzi na to pytanie.
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
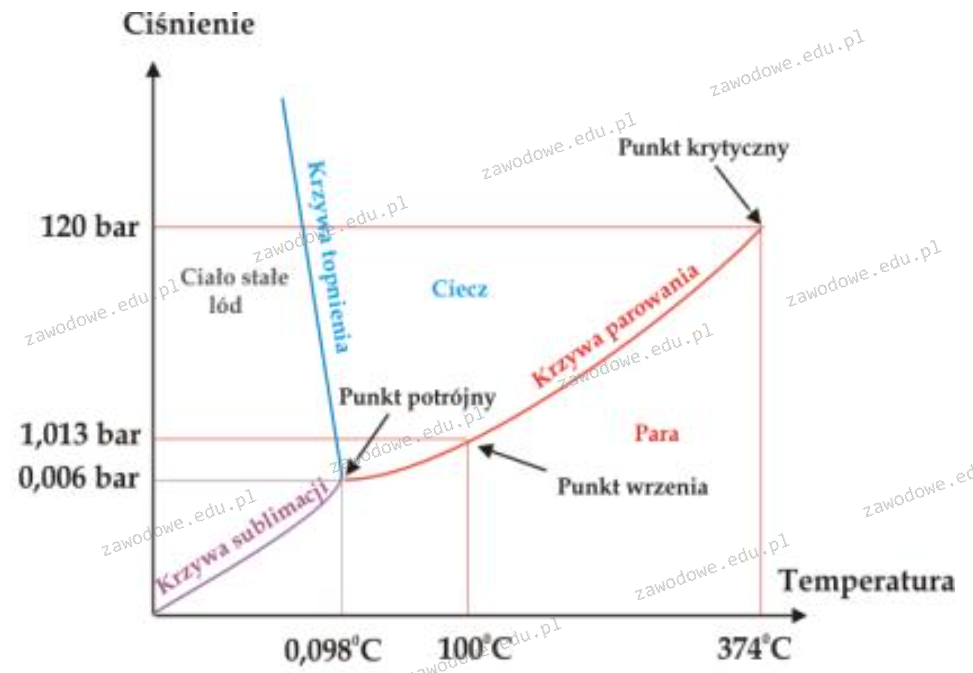
Brak odpowiedzi na to pytanie.
Odpady, które w przeważającej mierze składają się z osadów siarczków metali ciężkich, nazywa się
Brak odpowiedzi na to pytanie.
Jakie jest pH 0,001-molowego roztworu NaOH?
Brak odpowiedzi na to pytanie.
Przeprowadzono reakcję 13 g cynku z kwasem solnym zgodnie z równaniem: Zn + 2 HCl → ZnCl2 + H2↑. Otrzymano 1,12 dm3 wodoru (w warunkach normalnych). Masy molowe to: MZn = 65 g/mol, MH = 1g/mol, MCl = 35,5g/mol. Jaka jest wydajność tego procesu?
Brak odpowiedzi na to pytanie.
Reagent, który reaguje wyłącznie z jednym konkretnym jonem lub związkiem, nazywamy reagente
Brak odpowiedzi na to pytanie.
Aby oddzielić mieszankę etanolu i wody, konieczne jest przeprowadzenie procesu
Brak odpowiedzi na to pytanie.
Laboratoryjna apteczka powinna zawierać m.in.
Brak odpowiedzi na to pytanie.
Nie należy używać do czyszczenia szklanych naczyń laboratoryjnych
Brak odpowiedzi na to pytanie.
Aby otrzymać 200 g roztworu siarczanu(VI) sodu o stężeniu 12%, należy wykorzystać
(Na – 23 g/mol; S – 32 g/mol; H – 1 g/mol; O – 16 g/mol)
Brak odpowiedzi na to pytanie.
Z partii materiału należy pobrać ogólną próbkę w ilości odpowiadającej promilowi całej partii. Na podstawie podanej informacji określ, ile pierwotnych próbek, każda ważąca 10 g, trzeba pobrać z partii cukru o masie 0,5 t, aby uzyskać reprezentatywną próbkę ogólną?
Brak odpowiedzi na to pytanie.
Jakie urządzenie jest wykorzystywane do oczyszczania próbki gazowej?
Brak odpowiedzi na to pytanie.
Który z procesów jest endotermiczny?
Brak odpowiedzi na to pytanie.
Jakiego odczynnika chemicznego, oprócz Na2Cr2O7, należy użyć do sporządzenia mieszaniny chromowej do czyszczenia sprzętu szklarskiego w laboratorium?
Brak odpowiedzi na to pytanie.
Aby odcedzić galaretowaty osad, konieczne jest użycie sączka
Brak odpowiedzi na to pytanie.
W laboratorium chemicznym systemy wodne zazwyczaj oznacza się kolorem zielonym
Brak odpowiedzi na to pytanie.
Eliminacja substancji organicznych z próbki poprzez jej spalenie nazywa się
Brak odpowiedzi na to pytanie.
Preparaty zawierające KOH (tzw. żrący potaż), oznaczone są symbolem S 1/2. Na podstawie informacji zawartych w tabeli, określ zasady przechowywania tych preparatów.
| Numer zwrotu S | Warunki bezpiecznego stosowania | Numer zwrotu S | Warunki bezpiecznego stosowania |
|---|---|---|---|
| S1 | Przechowywać pod zamknięciem | S12 | Nie przechowywać pojemnika szczelnie zamkniętego |
| S2 | Chronić przed dziećmi | S13 | Nie przechowywać razem z żywnością, napojami i karmą dla zwierząt |
| S3 | Przechowywać w chłodnym miejscu | S15 | Przechowywać z dala od źródeł ciepła |
| S4 | Nie przechowywać w pomieszczeniach mieszkalnych | S16 | Nie przechowywać w pobliżu źródeł zapłonu – nie palić tytoniu |
Brak odpowiedzi na to pytanie.
Aby przeprowadzić syntezę substancji organicznej w temperaturze 150°C, należy zastosować łaźnię
Brak odpowiedzi na to pytanie.
W przypadku zanieczyszczeń szklanych naczyń osadami o charakterze nieorganicznym, takimi jak wodorotlenki, tlenki oraz węglany, do ich oczyszczania używa się
Brak odpowiedzi na to pytanie.
Jakie środki stosuje się do czyszczenia szkła miarowego, które zostało zanieczyszczone substancjami tłustymi?
Brak odpowiedzi na to pytanie.
Proces oddzielania mieszaniny niejednorodnej, który zachodzi w wyniku opadania cząstek pod działaniem grawitacji, nazywamy
Brak odpowiedzi na to pytanie.
Do metalowego sprzętu laboratoryjnego używanego w praktykach analitycznych zalicza się
Brak odpowiedzi na to pytanie.
Jaką masę chlorku sodu można znaleźć w 150 g roztworu soli o stężeniu 5% (m/m)?
Brak odpowiedzi na to pytanie.
Najskuteczniejszą techniką separacji ketonu oraz kwasu karboksylowego obecnych w roztworze benzenowym jest
Brak odpowiedzi na to pytanie.
Sączenie osadów kłaczkowatych odbywa się przy użyciu sączków
Brak odpowiedzi na to pytanie.
Jakie czynniki wpływają na zmiany jakościowe w składzie próbki?
Brak odpowiedzi na to pytanie.
Mianowanie roztworu o stężeniu przybliżonym można wykonać poprzez
Brak odpowiedzi na to pytanie.
Jakie jest stężenie molowe kwasu siarkowego(VI) o zawartości 96% i gęstości 1,84 g/cm3?
Brak odpowiedzi na to pytanie.
Próbka, którą analizujemy, to bardzo rozcieńczony wodny roztwór soli nieorganicznych, który ma być poddany analizie. Proces, który można zastosować do zagęszczenia tego roztworu, to
Brak odpowiedzi na to pytanie.
Do grupy reagentów o szczególnym zastosowaniu nie wlicza się
Brak odpowiedzi na to pytanie.
Podaj nazwę reagentu chemicznego, który w specyficznych warunkach reaguje tylko z jednym jonem, pierwiastkiem lub związkiem chemicznym?
Brak odpowiedzi na to pytanie.