Pytanie 1
Aby przygotować roztwór wzorcowy potrzebny do oznaczania miana, konieczne jest użycie odczynnika chemicznego o czystości przynajmniej
Wynik: 32/40 punktów (80,0%)
Wymagane minimum: 20 punktów (50%)
Aby przygotować roztwór wzorcowy potrzebny do oznaczania miana, konieczne jest użycie odczynnika chemicznego o czystości przynajmniej
Wody pobrane ze studni powinny być przewożone w szczelnie zamkniętych butelkach z przezroczystego materiału
W karcie charakterystyki pewnej substancji znajduje się piktogram dotyczący transportu. Jest to substancja z grupy szkodliwych dla zdrowia

Przedstawiony schemat ideowy ilustruje proces syntezy z propanu C3H8 → C3H7Cl → C3H6 → C3H6(OH)2 → C3H5(OH)2Cl → C3H5(OH)3
Jakie środki należy zastosować do gaszenia pożaru metali, takich jak magnez, sód czy potas?
W wyniku reakcji 100 g azotanu(V) ołowiu(II) z jodkiem potasu otrzymano 120 g jodku ołowiu(II). Wydajność reakcji wyniosła
| Pb(NO3)2 + 2KI → PbI2 + 2KNO3 | |
| (MPb(NO3)2 = 331 g/mol, MKI = 166 g/mol, MPbI2 = 461 g/mol, MKNO3 = 101 g/mol) |
W którym z podanych równań reakcji dochodzi do zmiany stopni utlenienia atomów?
Podczas pobierania skoncentrowanego roztworu kwasu solnego konieczne jest pracowanie w włączonym dygestorium oraz zastosowanie
Do 300 g wody o temperaturze 30oC dodano 120 g substancji, co zaowocowało powstaniem roztworu nasyconego. Jaką ma rozpuszczalność ta substancja w temperaturze 30oC?
Jaką substancję wskaźnikową należy zastosować do ustalenia miana roztworu wodorotlenku sodu w reakcji z kwasem solnym, według przedstawionej procedury, która polega na odmierzeniu 25 cm3 roztworu HCl o stężeniu 0,20 mol/dm3 do kolby stożkowej, dodaniu 50 cm3 wody destylowanej, 2 kropli wskaźnika oraz miareczkowaniu roztworem NaOH do momentu zmiany koloru z czerwonego na żółty?
W przypadku odczynnika, w którym nawet najczulsze techniki analizy chemicznej nie są w stanie wykryć zanieczyszczeń, a jego badanie wymaga zastosowania metod opartych na zjawiskach fizycznych, zalicza się on do kategorii czystości
Podstawowa substancja w analizie miareczkowej charakteryzuje się następującymi właściwościami:
Ustalanie miana roztworu polega na
W probówce połączono roztwory CuSO4 oraz NaOH. Powstał niebieski osad, który po podgrzaniu zmienił kolor na czarny. Czarnym osadem jest
Losowo należy pobierać próbki z opakowań
Na etykiecie odważki analitycznej znajduje się napis: Z odważki tej można przygotować
Odważka analityczna azotan(V) srebra(I) AgNO3 0,1 mol/dm3 |
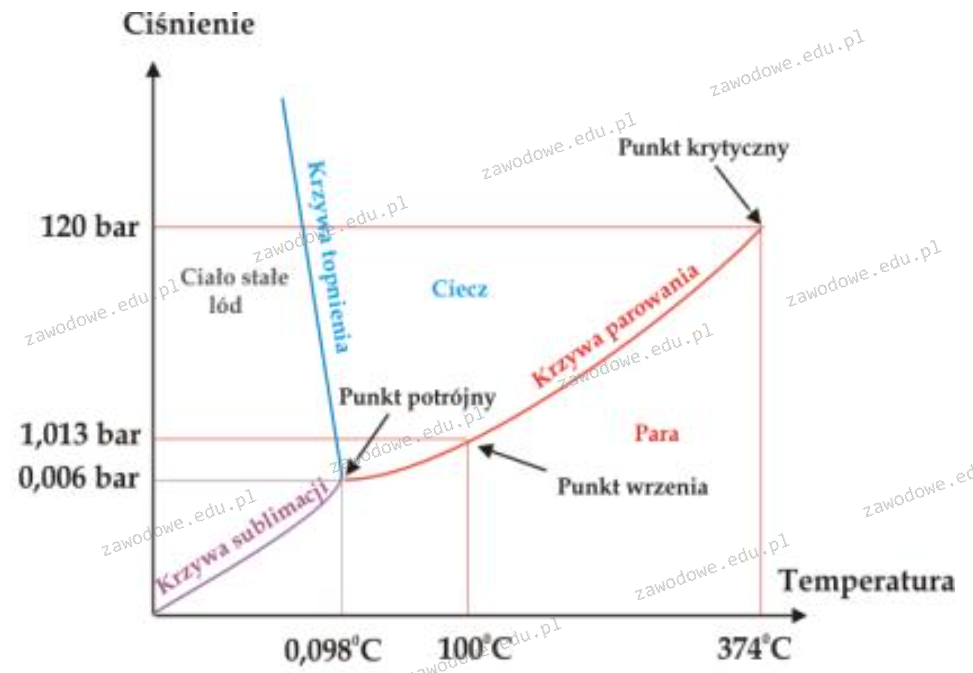
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Metoda oczyszczania substancji oparta na różnicach w rozpuszczalności poszczególnych składników w określonym rozpuszczalniku to
Oblicz masę wapienia, który został rozłożony, jeśli w trakcie reakcji uzyskano 44,8 dm3 CO2 (w warunkach standardowych).
MC = 12 g/mol, MCa = 40 g/mol, MO = 16 g/mol
Sposoby utrwalania i przechowywania próbek wody przeznaczonych do badań fizykochemicznych.
Próbkę wody przeznaczoną do oznaczenia zawartości metali poddaje się utrwalaniu za pomocą
| Oznaczenie | Sposób utrwalania i przechowywania |
|---|---|
| Barwa | Przechowywać w ciemności |
| Mętność | Przechowywać w ciemności |
| Twardość | pH = 3 z użyciem HNO3 |
| OWO | 0,7 ml HCl/30 ml próbki |
| ChZT | pH 1- 2 z użyciem H2SO4 |
| Fosfor | Przechowywać w temperaturze 1-5°C |
| Glin | pH 1-2 z użyciem HNO3 |
| Żelazo | pH 1-2 z użyciem HNO3 |
| Utlenialność | pH1-2 z użyciem H2SO4, Przechowywać w ciemności |
Na podstawie zmierzonej temperatury topnienia można określić związek organiczny oraz ustalić jego
Ogólna próbka, jednostkowa lub pierwotna powinna
W jakiej standardowej temperaturze są kalibrowane szklane naczynia pomiarowe?
Aby zregenerować rozpuszczalnik organiczny, należy wykonać proces
Aby przyspieszyć reakcję, należy zwiększyć stężenie substratów
Roztwór, który jest dodawany z biurety w formie kropli do roztworu substancji, którą analizujemy, określamy mianem
Który z wskaźników nie jest używany w alkacymetrii?
Jakie jest przeznaczenie pieca muflowego?
Jakie jest stężenie roztworu HNO3, który powstał w wyniku połączenia 50 cm3 roztworu HNO3 o stężeniu 0,2 mol/dm3 oraz 25 cm3 roztworu HNO3 o stężeniu 0,5 mol/dm3?
W wyniku analizy sitowej próbki stałej otrzymano frakcję o średnicy ziaren 12 – 30 mm. Jaką masę powinna mieć prawidłowo pobrana próbka pierwotna?
| Tabela. Wielkość próbki pierwotnej w zależności od wielkości ziarna | ||||
|---|---|---|---|---|
| Średnica ziaren lub kawałków [mm] | do 1 | 1 - 10 | 11 - 50 | ponad 50 |
| Pierwotna próbka (minimum) [g] | 100 | 200 | 1000 | 2500 |
Jakie jest stężenie molowe roztworu, jeśli w 100 cm3 roztworu znajduje się 5,6 g KOH?
MK = 39 g/mol, MO = 16 g/mol, MH = 1 g/mol
Odczynnik, który w specyficznych warunkach reaguje wyłącznie z danym jonem, umożliwiając tym samym jego identyfikację w mieszance, to odczynnik
Aby poprawić efektywność reakcji opisanej równaniem: HCOOH + C2H5OH ⇄ HCOOC2H5 + H2O, należy
Proces oddzielania cieczy od osadu nazywa się
Zabieg, który wykonuje się podczas pobierania próbki wody do analizy, mający na celu zachowanie jej składu chemicznego w trakcie transportu, określa się mianem
Fragment procedury analitycznej
(...) Przenieś badany roztwór całkowicie do rozdzielacza gruszkowego o pojemności od 50 do 100 cm3, dodaj 5 cm3 roztworu tiocyjanianu potasu oraz 10 cm3 alkoholu izopentylowego, a następnie wstrząsaj zawartością przez 30 sekund.
Po rozdzieleniu faz przenieś roztwór wodny do drugiego rozdzielacza, natomiast fazę organiczną do suchej kolbki miarowej o pojemności 50 cm3(...) Który rodzaj ekstrakcji jest opisany w powyższym fragmencie?
Wapno palone uzyskuje się poprzez prażenie wapienia według równania: CaCO3 → CaO + CO2. Ile kilogramów wapienia należy zastosować, aby w efekcie jego prażenia otrzymać 7 kg wapna palonego, jeśli wydajność reakcji wynosi 50%?
Masy molowe: MCa = 40 g/mol, MC = 12 g/mol, MO = 16 g/mol.
Odlanie cieczy z nad osadu to
Odczynnik, który nie został wykorzystany, należy zutylizować zgodnie z informacjami zawartymi na etykiecie
Korzystając z danych w tabeli wskaż, ile cm3 36% roztworu HCl należy użyć, aby przygotować 250 cm3 0,1-molowego roztworu tego kwasu.
| % wagowy [%] | d420 [g/cm3] | m HCl w 100 cm3 [g/100cm3] | CM HCl [mol/dm3] |
|---|---|---|---|
| 30 | 1,1492 | 34,48 | 9,46 |
| 32 | 1,1593 | 37,10 | 10,17 |
| 34 | 1,1691 | 39,75 | 10,90 |
| 36 | 1,1789 | 42,44 | 11,64 |