Pytanie 1
Zabieg, który wykonuje się podczas pobierania próbki wody do analizy, mający na celu zachowanie jej składu chemicznego w trakcie transportu, określa się mianem
Wynik: 30/40 punktów (75,0%)
Wymagane minimum: 20 punktów (50%)
Zabieg, który wykonuje się podczas pobierania próbki wody do analizy, mający na celu zachowanie jej składu chemicznego w trakcie transportu, określa się mianem
Na podstawie danych w tabeli określ, jaką masę próbki należy pobrać, jeżeli wielkość ziarna wynosi 1·10-5 m.
| Wielkość ziaren lub kawałków [mm] | Poniżej 1 | 1-10 | 11-50 | Ponad 50 |
|---|---|---|---|---|
| Pierwotna próbka (minimum) [g] | 100 | 200 | 1000 | 2500 |
W trakcie reakcji estryfikacji opisanej równaniem CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O użyto molowego stosunku alkoholu do kwasu wynoszącego 1:10. W rezultacie tego
Maksymalna średnica ziaren w partii substancji stałej wynosi 0,5 cm. Zgodnie z danymi zawartymi w tabeli próbka pierwotna tej substancji powinna mieć masę minimum
| Tabela. Masa próbki pierwotnej w zależności od wielkości ziaren lub kawałków | ||||
| Średnica ziaren lub kawałków [mm] | do 1 | 1 - 10 | 11 - 50 | ponad 50 |
| Pierwotna próbka (minimum) [g] | 100 | 200 | 1000 | 2500 |
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
Na podstawie informacji zawartych w tabeli wskaż mieszaninę oziębiającą o temperaturze -21 °C.
| Temperatura mieszaniny | Skład mieszaniny | Stosunek masowy |
| -15 °C | lód + octan sodu | 10:9 |
| -18 °C | lód + chlorek amonu | 10:3 |
| -21 °C | lód + chlorek sodu | 3:1 |
| -25 °C | lód + azotan amonu | 1:9 |
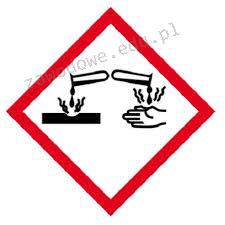
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Po zakończeniu pomiarów pH, elektrody powinny być przepłukane
Waga przedstawiona na rysunku umożliwia ważenie substancji z dokładnością do

Na podstawie danych w tabeli wskaż, którego środka suszącego można użyć do osuszenia związku o wzorze (CH3)2CO
| Środek suszący | Stosowany do suszenia | Nie nadaje się do suszenia |
|---|---|---|
| Na | Eter, węglowodory, aminy trzeciorzędowe | Chlorowcopochodne węglowodorów |
| CaCl₂ | Węglowodory, aceton, eter, gazy obojętne | Alkohole, amoniak, aminy |
| Żel krzemionkowy | W eksykatorze | HF |
| H₂SO₄ | Gazy obojętne i kwasowe | Związki nienasycone, alkohole, substancje zasadowe |
Jak nazywa się naczynie o płaskim dnie, które wykorzystuje się do pozyskiwania substancji stałej poprzez stopniowe odparowanie rozpuszczalnika z roztworu?
Aby przygotować 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3, jaką kolbę miarową o pojemności należy wykorzystać?
Jakiego koloru nabierze lakmus w roztworze NaOH?
Masa molowa kwasu azotowego(V) wynosi 63,0 g/mol. Jakie jest stężenie molowe 20% roztworu tego kwasu o gęstości 1,1 g/cm3?
Jakie metody można zastosować do rozdzielania i koncentracji składników próbki?
Aby oszacować czystość MgCO3, poddano prażeniu próbkę o wadze 5 g tej soli aż do osiągnięcia stałej masy. W trakcie prażenia zachodzi reakcja:
MgCO3 → MgO + CO2 Całkowity ubytek masy wyniósł 2,38 g.
(Masy molowe reagentów to: MgCO3 – 84 g/mol, MgO – 40 g/mol, CO2 – 44 g/mol) Jaką czystość miała próbka węglanu magnezu?
Jakie jest stężenie molowe roztworu, jeśli w 100 cm3 roztworu znajduje się 5,6 g KOH?
MK = 39 g/mol, MO = 16 g/mol, MH = 1 g/mol
Z podanych w tabeli danych wybierz sprzęt potrzebny do zmontowania zestawu do destylacji z parą wodną.
| 1 | 2 | 3 | 4 | 5 |
| manometr | kociołek miedziany | chłodnica powietrzna | kolba destylacyjna | odbieralnik |
W trakcie określania miana roztworu NaOH, do zmiareczkowania 25,0 cm3 tego roztworu, użyto 30,0 cm3 roztworu HCl o stężeniu 0,1000 mol/dm3. Jakie miało miano zasady?
Aby otrzymać czystą substancję, próbka z nitroaniliną została poddana procesowi krystalizacji. Jaką masę nitroaniliny użyto do krystalizacji, jeśli uzyskano 1,5 g czystego związku, a wydajność krystalizacji wyniosła 75%?
Substancje pomocnicze wykorzystywane do realizacji podstawowych analiz jakościowych i ilościowych, które nie wymagają wysokiej czystości, są oznaczane na opakowaniach symbolem
Miesięczne zapotrzebowanie laboratorium analitycznego na 2-propanol wynosi 500 cm3. Na jak długo wystarczy ta substancja?
Naważkę NaOH o masie 0,0400 g rozpuścić w małej ilości wody, a następnie przelać ten roztwór do kolby miarowej o pojemności 500 cm3 i uzupełnić kolbę miarową wodą do tzw. kreski. Masa molowa NaOH wynosi 40,0 g/mol. Jakie jest stężenie molowe przygotowanego roztworu?
W laboratorium chemicznym systemy wodne zazwyczaj oznacza się kolorem zielonym
Fosfor biały, z uwagi na swoje właściwości, powinien być przechowywany
Aby pobrać dokładnie 20 cm3 próbkę wody do przeprowadzenia analiz, należy zastosować
Laboratoryjny aparat szklany, który wykorzystuje kwasy do wytwarzania gazów w reakcji z metalem lub odpowiednią solą, to
Który z podanych związków chemicznych można wykorzystać do oceny całkowitego usunięcia jonów chlorkowych z osadu?
Które spośród substancji wymienionych w tabeli pozwolą pochłonąć wydzielający się tlenek węgla(IV)?
| I | II | III | IV | V |
|---|---|---|---|---|
| Ca(OH)2(aq) | NaOH(s) | HNO3(stęż) | CuO(s) | CaO(s) |
Czułość bezwzględna wagi definiuje się jako
W probówce połączono roztwory CuSO4 oraz NaOH. Powstał niebieski osad, który po podgrzaniu zmienił kolor na czarny. Czarnym osadem jest
Chemikalia, dla których upłynął okres przydatności,
Proces nastawiania miana kwasu solnego na wodorowęglan potasu KHCO3 przebiega zgodnie z następującą instrukcją:
Na wadze analitycznej odmierzyć 1 g KHCO3 (z precyzją 0,00001 g) i przesypać go ilościowo do kolby stożkowej, dodać około 50 cm3 destylowanej wody i dokładnie wymieszać roztwór. Następnie dodać kilka kropel roztworu czerwieni metylowej. Przeprowadzić miareczkowanie kwasem aż do pierwszej zmiany koloru wskaźnika.
W tym przypadku titrantem jest
Reagenty o najwyższej czystości to reagenty
Z partii materiału należy pobrać ogólną próbkę w ilości odpowiadającej promilowi całej partii. Na podstawie podanej informacji określ, ile pierwotnych próbek, każda ważąca 10 g, trzeba pobrać z partii cukru o masie 0,5 t, aby uzyskać reprezentatywną próbkę ogólną?
Który z poniższych czynników nie mógł przyczynić się do błędnego określenia całkowitej liczby drobnoustrojów w surowym mleku?
Jakie procesy towarzyszy efekt egzotermiczny?
Rozpuszczalnik stosowany w procesie krystalizacji powinien
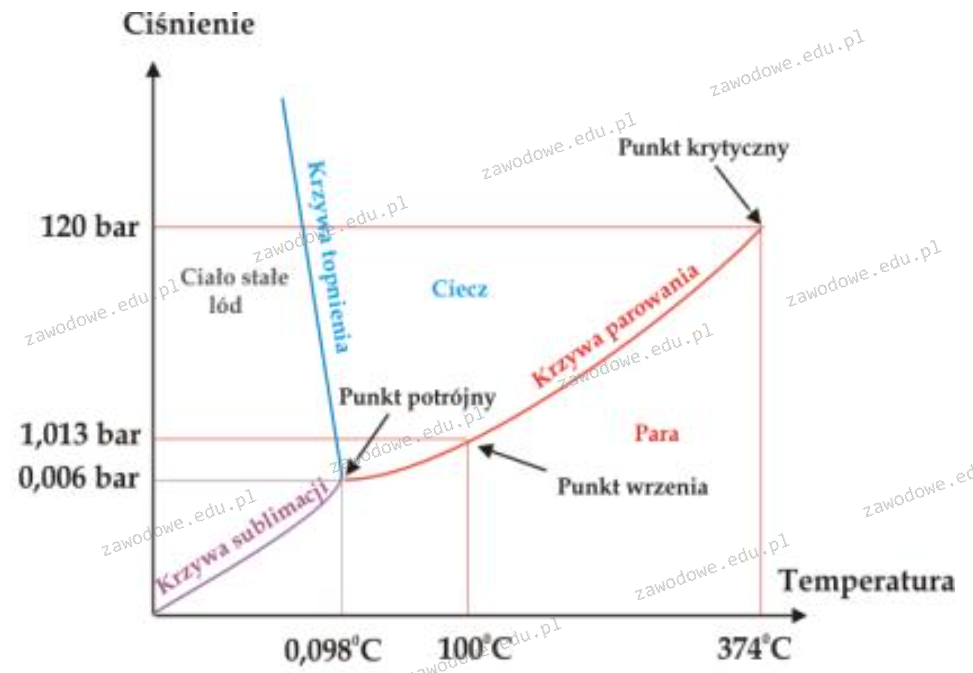
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Aby uzyskać Cr2O3, dichromian(VI) amonu został poddany rozkładowi. Po rozpoczęciu, egzotermiczna reakcja rozkładu przebiega samorzutnie.
(NH4)2Cr2O7 → Cr2O3 + 4 H2O + N2 Jak oceniasz zakończenie tej reakcji?