Pytanie 1
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wynik: 38/40 punktów (95,0%)
Wymagane minimum: 20 punktów (50%)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do grupy reagentów o szczególnym zastosowaniu nie wlicza się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Waga przedstawiona na rysunku umożliwia ważenie substancji z dokładnością do

Jaką próbkę stanowi woreczek gleby pobranej zgodnie z instrukcją?
| Instrukcja pobierania próbek glebowych | |
| Próbki pierwotne pobiera się laską glebową z wierzchniej warstwy gleby 0-20 cm, kolejno wykonując czynności: – w miejscu pobierania próbki pierwotnej (pojedynczej), rolę świeżo zaoraną przydeptać, – pionowo ustawić laskę do powierzchni gleby, – wcisnąć laskę do oporu (na wysokość poprzeczki ograniczającej), – wykonać pełny obrót i wyjąć laskę, – zawartość wgłębienia (zasobnika) przenieść do pojemnika skrobaczki. Po pobraniu próbek pojedynczych, całość wymieszać i napełnić kartonik lub woreczek. | |
Aby zregenerować rozpuszczalnik organiczny, należy wykonać proces
Na etykiecie odważki analitycznej znajduje się napis: Z odważki tej można przygotować
Odważka analityczna azotan(V) srebra(I) AgNO3 0,1 mol/dm3 |
Technika kwartowania (ćwiartkowania) pozwala na redukcję masy próbki ogólnej
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Nie należy używać do czyszczenia szklanych naczyń laboratoryjnych
W trzech probówkach umieszczono roztwory: wodorotlenku sodu, chlorku sodu i kwasu octowego. W celu identyfikacji zbadano ich odczyn za pomocą uniwersalnego papierka wskaźnikowego, a następnie fenoloftaleiny. Barwy wskaźników w badanych roztworach przedstawiono w tabeli:
| Wskaźnik | Barwa wskaźnika | ||
|---|---|---|---|
| próbówka nr 1 | próbówka nr 2 | próbówka nr 3 | |
| uniwersalny papierek wskaźnikowy | żółty | czerwony | niebieski |
| fenoloftaleina | bezbarwny | bezbarwny | malinowa |
Sporządzono 250 cm3 roztworu glicerolu o gęstości 1,05 g/cm3 w temperaturze 20°C. Korzystając z danych zamieszczonych w tabeli, określ stężenie procentowe sporządzonego roztworu glicerolu.
| Glicerolu [%] | 10% | 20% | 30% | 50% |
|---|---|---|---|---|
| d20 [g/dm3] | 1023,70 | 1048,40 | 1073,95 | 1127,20 |
Odpady z rozpuszczalników organicznych, takich jak benzen czy aceton, zawierające co najmniej 80% danego rozpuszczalnika, należy
Do przechowywania zamrożonych próbek wody stosuje się naczynia wykonane
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W trakcie określania miana roztworu NaOH, do zmiareczkowania 25,0 cm3 tego roztworu, użyto 30,0 cm3 roztworu HCl o stężeniu 0,1000 mol/dm3. Jakie miało miano zasady?
200 g soli zostało poddane procesowi oczyszczania poprzez krystalizację. Uzyskano 125 g czystego produktu. Jaką wydajność miała krystalizacja?
Transformacja zolu w żel to zjawisko określane jako
Jakim narzędziem dokonuje się poboru próbki wody?
W karcie charakterystyki substancji znajduje się piktogram, którym powinna być oznakowana substancja

Na ilustracji oznaczono numery 1 i 4:
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Analiza technicznego kwasu solnego dała następujące wyniki: 30% HCl, 0,008% H2SO4, 0,04% Fe.
Korzystając z zamieszczonej tabeli wymagań, określ gatunek kwasu, pamiętając, że decyduje o nim najgorszy wskaźnik.
| Wymagania chemiczne dotyczące kwasu siarkowego | ||||
| Wymagania | Gatunki | |||
| I | II | III | IV | |
| Chlorowodór, % | > 33 | > 29 | > 28 | > 27 |
| Kwas siarkowy(VI) w przel. na SO42-, % | < 0,009 | < 0,5 | < 1,6 | < 1,8 |
| Żelazo (Fe3+), % | < 0,005 | < 0,03 | < 0,03 | < 0,05 |
Podczas pobierania skoncentrowanego roztworu kwasu solnego konieczne jest pracowanie w włączonym dygestorium oraz zastosowanie
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Podaj nazwę reagentu chemicznego, który w specyficznych warunkach reaguje tylko z jednym jonem, pierwiastkiem lub związkiem chemicznym?
Wskaż definicję fiksanali?
Na skutek krystalizacji 18 g kwasu benzoesowego uzyskano 8 g czystego produktu. Jaką wydajność miała ta krystalizacja?
Przedstawiono wyciąg z karty charakterystyki substancji chemicznej. Na podstawie informacji zawartej w zamieszczonym fragmencie karty wskaż wzór chemiczny substancji, której można użyć jako materiału neutralizującego lodowaty kwas octowy.
Kwas octowy lodowaty 99,5% Materiały zapobiegające rozprzestrzenianiu się skażenia i służące do usuwania skażenia Jeżeli to możliwe i bezpieczne, zlikwidować lub ograniczyć wyciek (uszczelnić, zamknąć dopływ cieczy, uszkodzone opakowanie umieścić w opakowaniu awaryjnym). Ograniczyć rozprzestrzenianie się rozlewiska przez obwałowanie terenu; zebrane duże ilości cieczy odpompować. Małe ilości rozlanej cieczy przysypać niepalnym materiałem chłonnym (ziemia, piasek oraz materiałami neutralizującymi kwasy, np. węglanem wapnia lub sodu, zmielonym wapieniem, dolomitem), zebrać do zamykanego pojemnika i przekazać do zniszczenia. Zanieczyszczoną powierzchnię spłukać wodą. Popłuczyny zebrać i usunąć jako odpad niebezpieczny. |
W standardowym układzie destylacyjnym, który ma ukośną chłodnicę, wykorzystuje się chłodnicę
Proces oddzielania składników jednorodnej mieszaniny, polegający na eliminacji jednego lub większej ilości składników z roztworu lub substancji stałej przy użyciu odpowiednio wybranego rozpuszczalnika, to
Który z procesów jest endotermiczny?
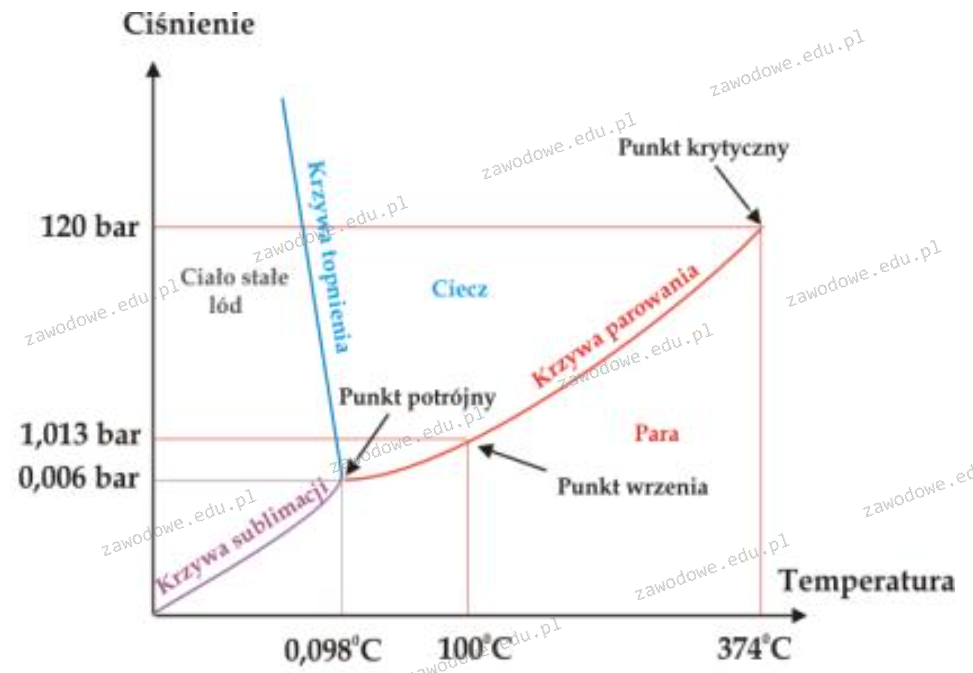
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Użycie płuczek jest konieczne w trakcie procesu
W karcie charakterystyki chemikaliów znajduje się informacja o przechowywaniu dichromianu(VI) potasu: .. powinien być przechowywany w odpowiednio oznakowanych, szczelnie zamkniętych pojemnikach, w chłodnym, suchym i dobrze wentylowanym magazynie, który posiada instalację elektryczną i wentylacyjną. Z tego opisu wynika, że ten chemikal może być przechowywany
Naczynia miarowe o kształcie rurek poszerzonych w środku, z wąskim i wydłużonym dolnym końcem, przeznaczone do pobierania i transportowania cieczy o ściśle określonej objętości, to
Etykieta roztworu kwasu azotowego(V) o koncentracji 6 mol/dm3 powinna zawierać nazwę substancji oraz