Pytanie 1
Na ilustracji oznaczono numery 1 i 4:
Wynik: 35/40 punktów (87,5%)
Wymagane minimum: 20 punktów (50%)
Na ilustracji oznaczono numery 1 i 4:
Wybierz spośród wymienionych właściwości tę, która nie dotyczy naczyń kwarcowych.
Aby przygotować zestaw do filtracji, należy zebrać
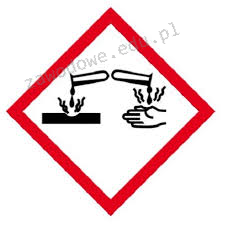
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
Czego się używa w produkcji z porcelany?
Jakie urządzenie jest wykorzystywane do oczyszczania próbki gazowej?
W tabeli zestawiono objętości molowe czterech gazów odmierzone w warunkach normalnych.
Dla którego spośród wymienionych w tabeli gazów objętość molowa najbardziej odchyla się od wartości obliczonej dla gazu doskonałego?
| Gaz | SO2 | CHCl3(para) | O3 | NH3 |
|---|---|---|---|---|
| Objętość molowa (dm3/mol) | 21,89 | 22,60 | 21,6 | 22,08 |
Na podstawie zmierzonej temperatury topnienia można określić związek organiczny oraz ustalić jego
Najwyżej czyste odczynniki chemiczne to odczynniki
Aby w badanej próbie w trakcie zmiany pH nastąpiła zmiana barwy na malinową, należy użyć
| Zmiany barw najważniejszych wskaźników kwasowo-zasadowych | ||||
|---|---|---|---|---|
| Wskaźnik | Barwa w środowisku | Zakres pH zmiany barwy | ||
| Kwasowym | Obojętnym | Zasadowym | ||
| oranż metylowy | czerwona | żółta | żółta | 3,2÷4,4 |
| lakmus (mieszanina substancji) | czerwona | fioletowa | niebieska | 4,5÷8,2 |
| fenoloftaleina | bezbarwna | bezbarwna | malinowa | 8,2÷10,0 |
| wskaźnik uniwersalny (mieszanina substancji) | czerwona (silnie kwaśne) pomarańczowa (słabo kwaśne) | żółta | niebieska (silnie zasadowe) zielona (słabo zasadowe) | co jeden stopień skali |
| herbata | żółta | czerwona-brunatna | brązowa | |
| sok z czerwonej kapusty | fioletowa | niebieska | zielona | |
W trakcie pobierania próbek wody, które mają być analizowane pod kątem składników podatnych na rozkład fotochemiczny, należy
Do systemu odprowadzania ścieków, w formie rozcieńczonego roztworu wodnego o maksymalnej masie 100 g na raz, można wprowadzić
Którą z poniższych czynności należy wykonać, aby zapewnić wysoką dokładność pomiaru masy substancji podczas przygotowywania próbki do analizy chemicznej?
Wskaż metodę rozdzielenia układu, w którym fazą rozproszoną jest ciało stałe, a fazą rozpraszającą gaz.
| faza rozproszona | faza rozpraszająca | ||
|---|---|---|---|
| gaz | ciecz | ciało stałe | |
| gaz | - | piana | piana stała |
| ciecz | aerozol ciekły | emulsja | emulsja stała |
| ciało stałe | aerozol stały | zol | zol stały |
Czystość konkretnego odczynnika chemicznego wynosi: 99,9-99,99%. Jakiego rodzaju jest ten odczynnik?
Laboratoryjny stół powinien być zaopatrzony w instalację gazową oraz
Substancje kancerogenne to
Proces chemiczny, który polega na przejściu substancji w stanie stałym do roztworu, związany z reakcją tej substancji z rozpuszczalnikiem, to
W parownicy porcelanowej, w której znajduje się 2,5 g naftalenu, umieść krążek bibuły z niewielkimi otworami oraz odwrócony lejek szklany. Zatyczkę lejka zrób z korka z waty. Parownicę umieść w płaszczu grzejnym. Po delikatnym ogrzaniu parownicy, pary substancji przechodzą przez otwory w bibule i kondensują na wewnętrznych ściankach lejka... Powyższy opis dotyczy metody oczyszczania naftalenu przez
Wybierz poprawny zapis jonowy spośród podanych reakcji, w których otrzymywany jest siarczan(VI) baru.
Butle gazowe (czasy butli) napełnione wodorem są oznaczone kolorem
Roztwory, które wykorzystuje się do kalibracji pehametrów, to
Aby ustalić miano roztworu wodnego NaOH, należy zastosować
Reagenty o najwyższej czystości to reagenty
Substancje chemiczne, które zazwyczaj wykorzystuje się w eksperymentach preparatywnych oraz w jakościowych analizach, charakteryzujące się czystością w przedziale 99-99,9%, nazywa się
Fosfor biały, z uwagi na swoje właściwości, powinien być przechowywany
Podczas pomiaru masy substancji w naczyniu wagowym na wadze technicznej, dla zrównoważenia ciężaru na szalce umieszczono odważniki: 20 g, 2 g, 500 mg, 200 mg, 20 mg, 10 mg, 10 mg oraz 5 g. Całkowita masa substancji z naczynkiem wyniosła
W trakcie destylacji cieczy wykorzystuje się tzw. kamienie wrzenne, ponieważ
Który z poniższych czynników nie mógł przyczynić się do błędnego określenia całkowitej liczby drobnoustrojów w surowym mleku?
Reakcja neutralizacji wodorotlenku sodu z kwasem solnym zrealizowana jest zgodnie z równaniem:
NaOH + HCl → NaCl + H2O Masy molowe: MNaOH = 40 g/mol, MHCl = 36,5 g/mol Aby zneutralizować 10 g wodorotlenku sodu, wymagane jest
Połączono równe ilości cynku i bromu, a następnie poddano je reakcji Zn + Br2 → ZnBr2. W tych warunkach stopień reakcji cynku wynosi (masy atomowe: Zn – 65u, Br – 80u)?
Jaką masę NaCl uzyskuje się poprzez odparowanie do sucha 250 g roztworu 10%?
W karcie charakterystyki substancji znajduje się piktogram, którym powinna być oznakowana substancja

Jak nazywa się proces, w którym następuje wytrącenie ciała stałego z przesyconego roztworu w wyniku spadku temperatury?
Aby wykonać czynności analityczne wskazane w ramce, należy użyć:
| Otrzymaną do badań próbkę badanego roztworu rozcieńczyć wodą destylowaną w kolbie miarowej o pojemności 100 cm3 do kreski i dokładnie wymieszać. Następnie przenieść pipetą 10 cm3 tego roztworu do kolby stożkowej, dodać ok. 50 cm3 wody destylowanej. |
W jakim stosunku objętościowym należy połączyć roztwór o stężeniu 5 mol/dm3 z wodą destylowaną, aby uzyskać roztwór o stężeniu 3 mol/dm3?
Naważkę NaOH o masie 0,0400 g rozpuścić w małej ilości wody, a następnie przelać ten roztwór do kolby miarowej o pojemności 500 cm3 i uzupełnić kolbę miarową wodą do tzw. kreski. Masa molowa NaOH wynosi 40,0 g/mol. Jakie jest stężenie molowe przygotowanego roztworu?
Średnia masa wody wypływająca z pipety o deklarowanej pojemności 25 cm3, w temperaturze 25°C wynosi 24,80 g. Korzystając z danych zamieszczonych w tabeli wskaż wartość poprawki kalibracyjnej dla tej pipety.
| Masa wody zajmującej objętość 1 dm3 w zależności od temperatury pomiaru | |
|---|---|
| Temperatura °C | Masa wody g |
| 20 | 997,17 |
| 21 | 997,00 |
| 22 | 996,80 |
| 23 | 996,59 |
| 24 | 996,38 |
| 25 | 996,16 |
| 26 | 995,93 |
| 27 | 995,69 |
| 28 | 995,45 |
| 29 | 995,18 |
| 30 | 994,92 |
Na podstawie informacji zawartej na pipecie, została ona skalibrowana na
Po rozpuszczeniu substancji w kolbie miarowej, należy odczekać przed dopełnieniem jej wodą "do kreski" miarowej. Taki sposób postępowania jest uzasadniony