Pytanie 1
200 g soli zostało poddane procesowi oczyszczania poprzez krystalizację. Uzyskano 125 g czystego produktu. Jaką wydajność miała krystalizacja?
Wynik: 39/40 punktów (97,5%)
Wymagane minimum: 20 punktów (50%)
200 g soli zostało poddane procesowi oczyszczania poprzez krystalizację. Uzyskano 125 g czystego produktu. Jaką wydajność miała krystalizacja?
Jak definiuje się próbkę wzorcową?
Pierwotna próbka jest zbierana
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Która część małej partii materiału jest najczęściej pobierana w celu przygotowania próbki ogólnej?
W tabeli przestawiono dane dotyczące wybranych roztworów wodnych wodorotlenku sodu.
Oblicz masę wodorotlenku sodu, jaką należy rozpuścić w 200,0 cm3 wody, aby otrzymać roztwór o gęstości 1,0428 g/cm3.
| d420 [g/cm3] | masa NaOH [g/100 cm3] |
|---|---|
| 1,0095 | 1,01 |
| 1,0207 | 2,04 |
| 1,0428 | 4,17 |
| 1,0648 | 6,39 |
| 1,0869 | 8,70 |
| 1,1089 | 11,09 |
Laboratoryjna apteczka powinna zawierać m.in.
Z analizy wykresu wynika, że substancją o najniższej rozpuszczalności w wodzie w temperaturze 100°C jest
W tabeli zestawiono objętości molowe czterech gazów odmierzone w warunkach normalnych.
Dla którego spośród wymienionych w tabeli gazów objętość molowa najbardziej odchyla się od wartości obliczonej dla gazu doskonałego?
| Gaz | SO2 | CHCl3(para) | O3 | NH3 |
|---|---|---|---|---|
| Objętość molowa (dm3/mol) | 21,89 | 22,60 | 21,6 | 22,08 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Rozpuszczalnik stosowany w procesie krystalizacji powinien
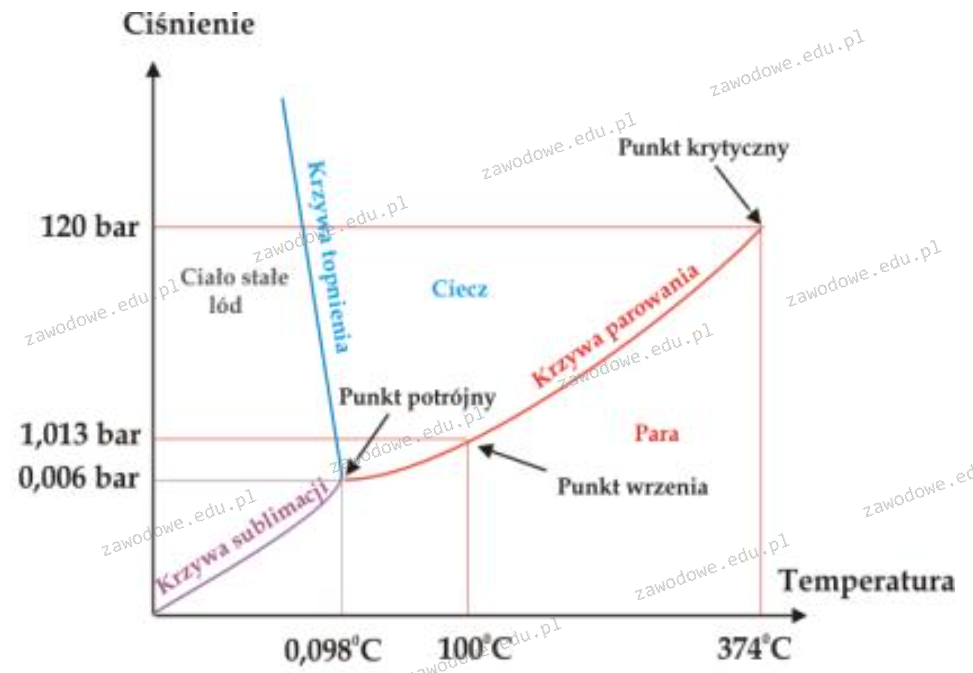
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Który z wskaźników nie jest używany w alkacymetrii?
Aby rozpuścić próbkę tłuszczu o wadze 5 g, wykorzystuje się 50 cm3 mieszanki 96% alkoholu etylowego oraz eteru dietylowego, połączonych w proporcji objętościowej 1 : 2. Jakie ilości cm3 każdego ze składników są potrzebne do przygotowania 150 cm3 tej mieszanki?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do narzędzi pomiarowych zalicza się
Analiza technicznego kwasu solnego dała następujące wyniki: 30% HCl, 0,008% H2SO4, 0,04% Fe.
Korzystając z zamieszczonej tabeli wymagań, określ gatunek kwasu, pamiętając, że decyduje o nim najgorszy wskaźnik.
| Wymagania chemiczne dotyczące kwasu siarkowego | ||||
| Wymagania | Gatunki | |||
| I | II | III | IV | |
| Chlorowodór, % | > 33 | > 29 | > 28 | > 27 |
| Kwas siarkowy(VI) w przel. na SO42-, % | < 0,009 | < 0,5 | < 1,6 | < 1,8 |
| Żelazo (Fe3+), % | < 0,005 | < 0,03 | < 0,03 | < 0,05 |
Do rozpuszczania próbek wykorzystuje się wodę królewską, która stanowi mieszaninę stężonych kwasów
Dekantacja to metoda
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W celu przeprowadzenia opisanego doświadczenia, należy przygotować:
| Opis procesu wydzielenia kwasu acetylosalicylowego z tabletek |
|---|
| Pięć rozgniecionych tabletek aspiryny (polopiryny) umieszcza się w kolbie stożkowej o pojemności 100 ml, dodaje 10 ml etanolu i ogrzewa na łaźni wodnej, aż do momentu rozpadnięcia się tabletek. W roztworze znajduje się kwas acetylosalicylowy, natomiast masa tabletkowa pozostaje w osadzie. Osad ten odsącza się na ogrzanym lejku szklanym zaopatrzonym w sączek karbowany. Do odebiornego przesączu dodaje się 20-30 ml zimnej wody destylowanej. Dodatek wody powoduje wypadanie osadu aspiryny z roztworu (zmniejsza się rozpuszczalność aspiryny w roztworze wodno-alkoholowym). Wydzielone kryształy odsączyć na lejku sitowym i suszyć na powietrzu. |
Do wykonania preparatu według zamieszczonej procedury należy przygotować wagę, łyżeczkę, palnik gazowy, trójnóg, bagietkę, szczypce metalowe oraz
| Procedura otrzymywania tlenku magnezu przez prażenie węglanu magnezu. Odważoną ilość węglanu magnezu ubić dokładnie w tyglu (wcześniej zważonym) i przykryć pokrywką. Początkowo ogrzewać niewielkim kopcącym płomieniem, a następnie gdy tygiel ogrzeje się, ogrzewać silniej w temperaturze czerwonego żaru przez około 20 minut. Po zakończeniu prażenia tygiel odstawić do ostudzenia chroniąc przed wilgocią. Zważyć tygiel z preparatem i obliczyć wydajność. |
Czułość bezwzględna wagi definiuje się jako
Aby podnieść stężenie mikroelementów w roztworze, próbkę należy poddać
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby uzyskać roztwór CuSO4 o stężeniu 15%, w jakim stosunku należy połączyć roztwory 10% oraz 20%?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Skuteczny środek do osuszania
W procesie oddzielania osadu od roztworu, po przeniesieniu osadu na sączek, najpierw należy go
Jakiego koloru nabierze lakmus w roztworze NaOH?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Podstawowy zestaw do filtracji, oprócz statywu i sączka, obejmuje
Do 200 g roztworu NaOH (M = 40 g/mol) o stężeniu 10 % dodano wodę destylowaną w kolbie miarowej o pojemności 500 cm3 do znaku. Jakie jest stężenie molowe powstałego roztworu?
Aby oddzielić mieszankę etanolu i wody, konieczne jest przeprowadzenie procesu
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Woda, która została poddana dwukrotnej destylacji, to woda
W przypadku kontaktu ze stężonym roztworem zasady, co należy zrobić jak najszybciej?